
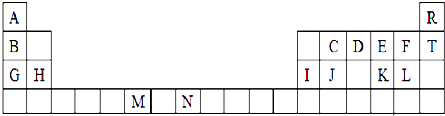
分析 由元素在周期表中位置,可知A为H,B为Li、C为C、D为N、E为O、F为F、G为Na、H为Mg、I为Al、J为Si、K为S、L为Cl、M为Cr、N为He、T为Ne元素,
(1)镁在二氧化面中燃烧生成碳和氧化镁;
(2)根据硫的价层电子对数判断硫的气态氢化物的VSEPR模型及其中心原子的杂化类型;
(3)同周期元素从左向右,第一电离能增大,但氮元素的最外层电子是半满结构是一种稳定结构,其第一电离能都高于同周期相邻元素,据此判断;
(4)由A、C、D形成的ACD分子为HCN,分子中碳氢之间有一个单键,碳氮之间是参键;
(5)氟化氢中分子间能形成氢键导致其相对分子质量测定时较大;
(6)①Cr的价电子为3d54s1,同周期中K的价电子为4s1,Cu的价电子为3d104s1;
②CCl4、CS2等为非极性分子,非极性分子易溶于非极性分子.
解答 解:由元素在周期表中位置,可知A为H,B为Li、C为C、D为N、E为O、F为F、G为Na、H为Mg、I为Al、J为Si、K为S、L为Cl、M为Cr、N为He、T为Ne元素,
(1)镁在二氧化面中燃烧生成碳和氧化镁,反应的方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)在硫化氢分子中,硫原子的价层电子对数为$\frac{6+2}{2}$=4,分子中有两对孤电子对,所以分子为V型,其中心原子的杂化方式为sp3,
故答案为:V型;sp3;
(3)同周期元素从左向右,第一电离能增大,但氮元素的最外层电子是半满结构是一种稳定结构,其第一电离能都高于同周期相邻元素,所以第一电离能N>O>C,
故答案为:N>O>C;
(4)由A、C、D形成的ACD分子为HCN,分子中碳氢之间有一个单键,为σ键,碳氮之间是参键,有一个和两个π键,所以共有2个σ键,2个π键
故答案为:2;2;
(5)氟化氢分子间能形成氢键导致其相对分子质量测定时较大,故答案为:氟化氢分子间能形成氢键;
(6)①Cr的价电子为3d54s1,同周期中K的价电子为4s1,Cu的价电子为3d104s1,则与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素有K、Cu,
故答案为:K、Cu;
②CCl4、CS2等为非极性分子,非极性分子易溶于非极性分子,MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,则MO2Cl2是非极性分子,
故答案为:非极性.
点评 本题考查位置、结构、性质的应用,题目综合性较强,涉及知识点较多,注重元素周期表、周期律与原子结构知识的结合来考查学生,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe→Fe3O4 | B. | HNO3→NO | C. | H2SO4 →CuSO4 | D. | Na2O→NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去BaSO4中的少量BaCO3加入足量盐酸,充分反应后,过滤、洗涤、干燥 | |
| B. | 除去KCl溶液中的少量MgCl2,加入适量NaOH溶液,过滤 | |
| C. | 除去CO2气体中混有的HCl气体:通过饱和碳酸氢钠溶液,洗气 | |
| D. | 除去碘水中的碘,加入乙醇萃取后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①④⑥ | C. | ③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL lmol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1NA | |
| B. | 7.8 g Na2O2中含有的离子总数目为0.4NA | |
| C. | 30g SiO2晶体中含有Si-O键的数目为2NA | |
| D. | 标准状况下44.8L HF溶于水配成溶液中所含F-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、Cl- | B. | Ca2+、Al3+、Br-、NO3- | ||
| C. | Na+、ClO-、SO42-、HCO3- | D. | Mg2+、Cl-、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼(B)及其化合物在化学中有重要的地位.请回答下列问题:
硼(B)及其化合物在化学中有重要的地位.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com