
【题目】已知25 ℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol·L-1。若在5 mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8 mL 0.01 mol·L-1AgNO3溶液,下列叙述正确的是( )
A.混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中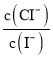 约为1.02×10-3
约为1.02×10-3
【答案】B
【解析】
A.KCl、KI混合溶液中加入AgNO3溶液,先生成AgI,再生成AgCl,AgNO3+KI=AgI↓+KNO3,n(KCl)=n(KI)=0.01 mol·L-1×5mL![]() 10-3=5.0×10-5mol,生成AgI消耗n(AgNO3)=5.0×10-5mol,剩余的AgNO3为0.01 mol·L-1×8 mL×10-3L·mL-1-5.0×10-5mol=3.0×10-5mol,与KCl发生反应后,KCl过量,生成AgCl为3.0×10-5mol,所以离子浓度c(Cl-) >c(Ag+),故A错误;
10-3=5.0×10-5mol,生成AgI消耗n(AgNO3)=5.0×10-5mol,剩余的AgNO3为0.01 mol·L-1×8 mL×10-3L·mL-1-5.0×10-5mol=3.0×10-5mol,与KCl发生反应后,KCl过量,生成AgCl为3.0×10-5mol,所以离子浓度c(Cl-) >c(Ag+),故A错误;
B.根据上述分析可知,混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故B项正确;
C.由25 ℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol·L-1可求Ksp(AgI)= c(Ag+)![]() c(I-)=(1.23×10-8)2=1.51
c(I-)=(1.23×10-8)2=1.51![]() 10-16, Ksp(AgCl)= c(Ag+)
10-16, Ksp(AgCl)= c(Ag+)![]() c(Cl-)=(1.25×10-5)2=1.56
c(Cl-)=(1.25×10-5)2=1.56![]() 10-10,所以Ksp(AgI)< Ksp(AgCl),因此加入AgNO3溶液,先生成AgI沉淀,故C错误;
10-10,所以Ksp(AgI)< Ksp(AgCl),因此加入AgNO3溶液,先生成AgI沉淀,故C错误;
D.混合溶液中 =
=![]() =
=![]() =1.03×106,故D错误;
=1.03×106,故D错误;
故答案:B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如图所示。
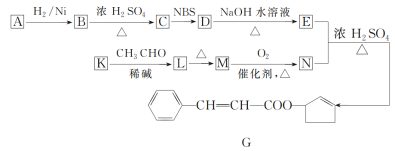
已知:ⅰ.A的分子式为C5H8O,其核磁共振氢谱显示有两组峰,其峰面积之比为1∶1;ⅱ.CH3CH2CH=CH2![]() CH3CHBrCH=CH2;
CH3CHBrCH=CH2;
CH3CHO+ CH3CHO![]()
![]() ;
;
![]()
![]() CH3CH=CHCHO+H2O。请回答下列问题:
CH3CH=CHCHO+H2O。请回答下列问题:
(1)G中含氧官能团的名称为_______,B生成C的反应类型为_______。
(2)A的结构简式为______。
(3)写出D→E的化学方程式:__________。
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_________。
(5)F是比M多一个碳原子的同系物,满足下列条件的F的同分异构体有_____种(不考虑立体异构),其中核磁共振氢谱显示5组峰的结构简式为_____。
①能发生银镜反应②能与溴的四氯化碳溶液发生加成反应③苯环上有2个取代基
(6)以2丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)____。请用以下方式表示: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子排布式__________________,核外电子占据最高能级的电子云形状为_________;基态As原子最高能层上有_______个电子。
(2)镓失去电子的逐级电离能(单位:kJmol1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的第一电离能比镓_____(填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为__________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中Ga原子的杂化方式为______,AsH3分子的空间构型为____________。
(5)相同压强下,AsH3的沸点______NH3(填“大于”或“小于”),原因为__________________
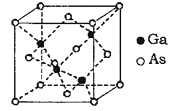
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以___________(填“共价键”或“离子键”)键合。设阿伏伽德罗常数的值为NA,该晶胞边长为a pm,则GaAs晶体的密度为_____gcm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质 ①Cu;②液态SO2;③纯醋酸;④NaHCO3;⑤Ba(OH)2溶液;⑥酒精。
I.属于非电解质的是_______________________;(填序号)
Ⅱ.(1)NaHCO3是一种 _________________(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:_____________________________________;
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:________________________。
III.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
(1)该Ba(OH)2溶液的物质的量浓度为___________________;
(2)溶液中由水电离出c(OH-)=______________;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A. 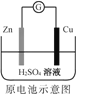 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 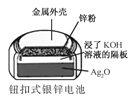 正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D. 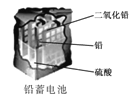 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭带活塞的容器中,反应达到平衡A(g)+2B(g)![]() 3C(?),测得C(A)=0.6mol/L,将容积体积缩小为原来的一半并重新达到平衡,测得C(A)=1.0mol/L,下列说法正确的是
3C(?),测得C(A)=0.6mol/L,将容积体积缩小为原来的一半并重新达到平衡,测得C(A)=1.0mol/L,下列说法正确的是
A.建立新平衡时,原平衡不移动B.建立新平衡时,原平衡向左移动
C.C为非气体物质,加压时平衡向右移动D.C为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是
2SO3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,v(SO2)与 v(SO3)相等
D.容器内气体的浓度 c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com