
【题目】在2L密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)![]() zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
A.z=4
B.B物质的转化率是20%
C.A的平衡浓度是1.6mol/L
D.平衡时气体压强是原来的![]()
【答案】A
【解析】
A.根据反应速率之比等于化学计量数之比来确定化学计量数。由3A(g)+2B(g)![]() zC(g)+2D(g),且v(D)=0.2mol/(L·min),则v(C)=
zC(g)+2D(g),且v(D)=0.2mol/(L·min),则v(C)= =0.4mol/(L·min),v(D):v(C)= 0.2:0.4=1:2,则z=4,故A正确;
=0.4mol/(L·min),v(D):v(C)= 0.2:0.4=1:2,则z=4,故A正确;
B.由反应 3A(g) + 2B(g) = 4C(g) + 2D(g),
开始量 4 2 0 0
变化量 1.2 0.8 1.6 0.8
平衡量 2.8 1.2 1.6 0.8
所以B的转化率=![]() ,故B错误;
,故B错误;
C. A的平衡浓度=![]() = 1.4mol/L,故C错误;
= 1.4mol/L,故C错误;
D.气体物质的量之比等于压强之比,平衡时气体压强是原来的=![]() =
=![]() ,故D错误;
,故D错误;
故选A。


科目:高中化学 来源: 题型:
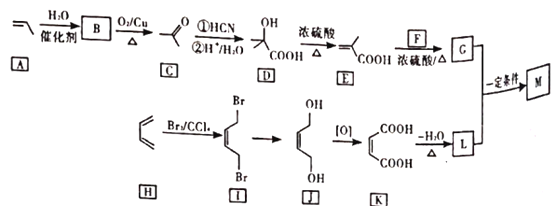
【题目】M是降低润滑油凝固点的高分子有机化合物,其结构简式为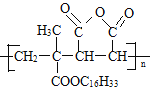 ,用石油裂解气合成M的路线图如图:
,用石油裂解气合成M的路线图如图:
回答下列问题:
(1)B的化学名称为______。
(2)F的分子式为_____。
(3)G中官能团的名称是_____,G与L在一定条件下生成M的反应类型为____。
(4)I→J的反应方程式为_____。
(5)写出2种符合条件的C的同分异构体的结构简式____。(核磁共振氢谱为三组峰,峰面积比为3:2:1;已知双键和羟基相连时物质不稳定)
(6)设计由苯乙烯为起始原料制备![]() 的合成路线(无机试剂任选)____。
的合成路线(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列说法正确的是( )

A. 正极的电极反应式为2H++2e-===H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件时平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中不正确的是

A.若t1=15s,则用A的浓度变化表示的t0~t1阶段的平均反应速率为0.006mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2L,B的起始物质的量为0.02mol
D.该反应的化学方程式为3A![]() B+2C
B+2C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka=1×10-6
B. b点时,c(B+)=c(A-)
C. c点时,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔(I)是预防和治疗手术期心动过速的一种药物,某合成路线如图,回答下列问题:

(1)A的化学名称为___,D中所含官能团的名称为____。
(2)G→H的反应类型为___,H→I的反应类型为___。
(3)C→D中步骤①的化学反应方程式为____。
(4)X是F的同分异构体,若同时满足下列条件中的①②④,则X有___种同分异构体;若同时满足下列条件中的①②⑤,则X有____种同分异构体;若同时满足下列条件中的①②③,请写出X的结构简式___。
①与碳酸氢钠溶液反应生成二氧化碳②与FeCl3溶液发生显色反应③核磁共振氢谱有四组峰且峰面积之比为6:2:1:1④苯环上只有两个取代基⑤苯环上只有三个取代基
(5)参照上述合成路线,设计以![]() 和
和 为主要原料制备
为主要原料制备 的合成路线。___
的合成路线。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.“神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐”“含氟牙膏”“富硒营养品”“高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C.下图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:2A(g)+B(g)=2C(g);△H=QkJ/mol(Q>0)

D.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为298K、308K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和___探究温度对该反应速率的影响; (Ⅲ)实验①和___探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=___(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为___,可能原因是___。
③反应速率最小的时间段为___,可能原因是___。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是___(填相应字母);
A.蒸馏水 B.NaNO3溶液 C.NaCl溶液 D.CuSO4溶液 E.Na2CO3
(4)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如图甲、乙所示的实验。请回答相关问题:
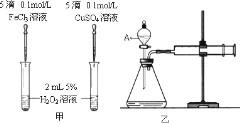
①定性如图甲可通过观察___,定性比较得出结论。甲同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。受甲同学的启发乙同学提出了另一种方案,你猜想乙同学的方案是___;
②定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com