
| A. | 体积不变充入N2使压强增大 | B. | 体积不变充入O2使压强增大 | ||
| C. | 使体积增大到原来的2倍 | D. | 体积不变充入氦气使压强增大 |
分析 该反应的正反应是反应前后气体体积减小的可逆反应,增大反应物浓度、增大压强、升高温度等方法都能加快反应速率,据此分析解答.
解答 解:A.体积不变充入N2使压强增大,氮气浓度增大,增大单位体积内活化分子个数,反应速率加快,故A正确;
B.体积不变充入O2使压强增大,氧气浓度增大,增大单位体积内活化分子个数,反应速率加快,故B正确;
C.使体积增大到原来的2倍,各物质浓度减小,导致反应速率降低,故C错误;
D.体积不变充入氦气使压强增大,氮气、氧气和NO浓度都不变,反应速率不变,故D错误;
故选AB.
点评 本题考查化学反应速率影响因素,为高频考点,明确化学反应速率影响原理是解本题关键,注意:压强增大反应速率不一定加快,易错选项是D.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L的 Na2S溶液中S2-的个数为0.1NA | |
| B. | 标准状况下,11.2LH2所含的中子数为0.15 NA | |
| C. | 7.8g Na2O2与足量的水反应,转移的电子数为0.2 NA | |
| D. | 1mol羟基所含电子数为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释或解决方法 |
| A | 大量的燃煤、燃油是形成雾霾的主要原因, | 发展核能等清洁能源,减少化石燃料的使用 |
| B | “地沟油”是被氧化、分解的油脂,禁止食用 | 采用化学技术处理后代替汽油作燃料 |
| C | 氢氧化钠与氢氟酸都能与硅、二氧化硅反应 | 硅、二氧化硅都具有两性 |
| D | 漂白粉在空气中久置变质是 | 漂白粉中的有效成分与空气中的CO2反应生成CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
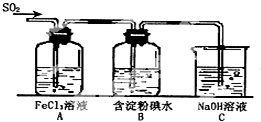 某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
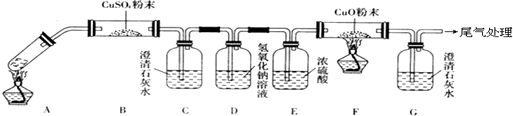
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
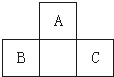 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )| A. | Be、Na、Al | B. | B、Mg、Si | C. | C、Al、P | D. | O、P、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a极是负极,b极是正极 | |
| B. | 负极的电极反应式为CH2═CH2+H2O+2e-═CH3CHO+2OH- | |
| C. | 当有0.1molO2反应时,会有0.4molH+迁移 | |
| D. | 电子移动方向:电极a→负载→电极b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com