
| 实验 步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水, 至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀,后沉淀溶解. |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大,反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大,反应速率慢. |
分析 ①银镜反应的关键有两个:1银氨溶液的配置,该反应是在碱性环境下发生;2反应的条件:水浴加热;
②AgNO3溶液与氨水反应生成氢氧化银沉淀,氢氧化银再和氨水发生络合反应生成可溶性络合物;
分别做两组银镜反应的实验,一组加少量碱,一组不加在相同的水浴条件下反应根据反应速率快慢解答;
③乙醛与银氨溶液反应生成醋酸铵、银单质、氨气和水,据此写出反应的化学方程式.
解答 解:①银镜反应的关键有两个:1银氨溶液的配置,该反应是在碱性环境下发生;2反应的条件:水浴加热,猜想:因素一:银氨溶液的pH大小,所以因素二:反应(水浴)的温度,
故答案为:反应(水浴)的温度;
②AgNO3溶液与氨水反应生成氢氧化银沉淀,氢氧化银再和氨水发生络合反应生成可溶性络合物,预期看到的现象为:先产生白色沉淀,然后沉淀逐渐溶解,故答案为:先产生白色沉淀,然后沉淀逐渐溶解;
要验证因素一:银氨溶液的pH大小对反应的影响,应该定住因素二,也就是在相同的热水浴中做pH值不同条件下的两组银镜反应,通过反应速率快慢验证结论,操作方法为:步骤1:在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液,反应现象为:先生成白色沉淀,后沉淀溶解;
步骤2:往A、B试管加入几滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在相同的热水浴中温热,若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢,
故答案为:
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解 | 先生成白色沉淀,后沉淀溶解 |
| 2 | 1滴NaOH溶液 | 则溶液pH大,反应速率快; 则溶液pH大,反应速率慢 |
点评 本题考查了探究影响化学反应速率的因素、银镜实验原理,题目难度中等,注意掌握影响化学反应速率的因素,明确银镜反应原理,能够正确书写常见反应的化学方程式.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ①②④⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
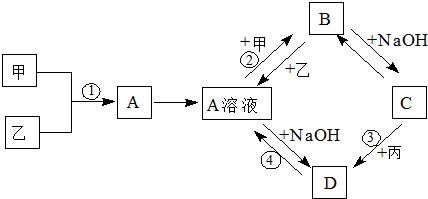
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
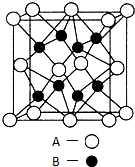 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
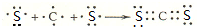 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

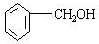 ;
; ;
;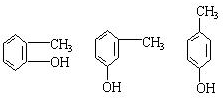
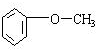 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
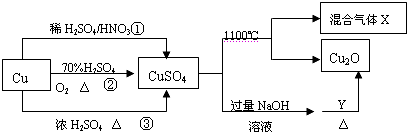
| A. | 1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol(X的组成为SO2、SO3、O2) | |
| B. | 相对于途径①、②,途径③更好地体现了绿色化学理念 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | Y一定是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ②③ | C. | ①② | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com