

| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| (三) | (一) | (五) | (二) | (六) | (四) |
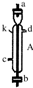 | 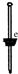 | 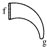 |  | 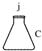 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:
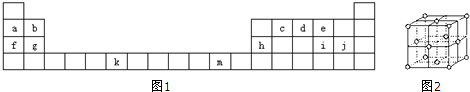
查看答案和解析>>
科目:高中化学 来源: 题型:
A、物质的量浓度(mol?L-1)与溶液质量分数、密度(g?cm-3)的关系为:c=
| ||
| B、此氨水中NH3的物质的量浓度近似为9.9 mol?L-1 | ||
| C、此氨水中NH3的物质的量浓度近似为8.55 mol?L-1 | ||
| D、此氨水中NH3的质量分数为0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、450ml,52.65g |
| B、任意规格,52.65g |
| C、500 ml,58.5g |
| D、1000 ml,117g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、② |
| C、①③④⑤ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改变温度 |
| B、恒容,充入N2 |
| C、恒容,充入He气 |
| D、恒压,充入He气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 热化学方程式 | △H大小比较 | |
| A | S(g)+O2(g)=SO2(g)△H1 | △H1<△H2[来源:] |
| S(s)+O2(g)=SO2(g)△H2 | ||
| B | 2H2(g)+O2(g)=2H2O(1)△H1 | △H1>△H2 |
| 2H2(g)+O2(g)=2H2O(g)△H2 | ||
| C | CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1)△H1 | △H1<△H2 |
| HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)△H2 | ||
| D | 2Na(s)+O2(g)=Na2O2(s)△H1 | △H1>△H2 |
| 4Na(s)+O2(g)=2Na2O(s)△H2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com