

分析 实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O,NH4Cl溶液中加入CoCl2•6H2O晶体溶解,得到溶液加入浓氨水和活性炭,加入过氧化氢,需要水浴加热保持温度50℃~60℃反应得到Co(NH3)6Cl3液,冷却过滤得到[Co(NH3)6]Cl3,将滤渣加入沸水中,充分搅拌,趁热过滤,向滤液中加入少量浓盐酸,用冰水浴冷却后过滤,再用少许乙醇洗涤,据此分析.
解答 解:(1)在碱性条件下容易生成氢氧化钴沉淀,因此原料NH4Cl的主要作用除了提供NH3以外,NH4Cl溶于水电离出NH4+会抑制NH3•H2O的电离,降低溶液的碱性,
故答案为:NH4Cl溶于水电离出NH4+会抑制NH3•H2O的电离;
(2)①氧化时须先加入氨水再加入H2O2,若先加过氧化氢,将+2加钴氧化到+3价,再加入氨水,会有Co(OH)3的生成,不利于产物的生成;
故答案为:防止Co(OH)3的生成;
②氧化过程中加入氨水和H2O2在溶液中生成Co(NH3)6Cl3的反应物为:H2O2+2CoCl2+2NH4Cl+10NH3•H2O=2Co(NH3)6Cl3+12H2O或H2O2+2CoCl2+2NH4Cl+10NH3=2Co(NH3)6Cl3+2H2O;
故答案为:H2O2+2CoCl2+2NH4Cl+10NH3•H2O=2Co(NH3)6Cl3+12H2O或H2O2+2CoCl2+2NH4Cl+10NH3=2Co(NH3)6Cl3+2H2O;
③用水浴加热控制反应温度在50℃~60℃之间;
故答案为:水浴加热;
(3)由图2可知Co(NH3)6Cl3水中的溶解度随温度的升高而增大,则为了降低三氯化六氨合钴的溶解度,提高产量,应冰水冷却;
故答案为:降低三氯化六氨合钴的溶解度,提高产量;
(4)由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案:将滤渣加入沸水中,充分搅拌,趁热过滤,向滤液中加入少量浓盐酸,用冰水浴冷却后过滤,再用少许乙醇洗涤;
故答案为:趁热过滤,向滤液中加入少量浓盐酸,用冰水浴冷却后过滤,再用少许乙醇洗涤.
点评 本题考查了物质制备实验方法,物质性质的理解应用是解题的关键,分析题干信息和物质性质是解题关键,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铁溶于水生成红褐色沉淀 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| D. | 铜在氯气中燃烧,产生棕黄色烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
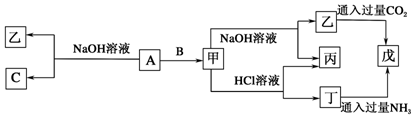
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.
2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.| 序号 | 实验装置 | 阳极实验现象 | 阴极 |
| 实验Ⅰ | 电压1.5V电解1 mol/L FeCl2溶液,pH=4.9 | 阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体. | 没有观察到气泡生成,铜电极表面有银灰色金属光泽的固体析出. |
| 实验序号 | pH | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅱ | 2.4 | 无 | 未变色 | 黄绿色,少量浑浊 | 无 | 有 |
| 实验Ⅲ | -0.4 | 无 | 未变色 | 黄绿色,无浑浊 | 有 | 无 |
| 实验序号 | 电压 (V) | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅳ | 3 | 无 | 未变色 | 缓慢变成黄绿色,有浑浊 | 少量 | 有,约1min |
| 实验Ⅴ | 6 | 少量 | 变蓝 | 很快变成黄绿色,有浑浊 | 大量 | 有,迅速 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液:MnO4-、Na+、I-、Mg2+ | |
| B. | 含有0.1mol/L Fe3+的溶液中:Na+、Ca2+、SCN-、SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32-、SO42-、Na+、NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+、Cl-、NO3-、Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com