
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
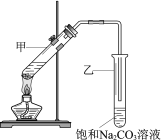
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应方程式是化学学习的基本工具,本学期在化学反应速率与化学平衡章节学过几个重要的方程式,请你按要求写出:
(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:________________。
(2)在重铬酸钾的硫酸溶液中的Cr2O72—与CrO42—之间转化的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂将制革工业污泥中的铬元素以难溶物CrOH(H2O)5SO4的形式回收,工艺流程如下,其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。

回答下列问题:
(1)4.8 mol/L的硫酸溶液密度为1.27g/cm3,该溶液中硫酸的质量分数是_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
①Cr (OH)3溶解于NaOH溶液时反应的离子方程式是___________。
②加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是______________________________。
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____________。
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,试回答:

(1)写出B的化学式_______________,D的化学式_______________________。
(2)写出由B转变成E的化学方程式_____________________________。
(3)写出用KSCN鉴别G溶液的离子方程式______________;向G溶液加入A的有关离子反应方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钾可用于有机合成、制药等领域,它是一种白色立方结晶或粉末,易溶于水。有两个学习小组查阅资料后,分别设计以下实验装置制备KI:
【查阅资料】:
(1)3I2+6KOH═KIO3+5KI+3H2O
(2)H2S是有剧毒的酸性气体,具有较强还原性,水溶液称氢硫酸(弱酸);
(3)HCOOH(甲酸)具有强烈刺激性气味的液体,具有较强还原性,弱酸;
(4)在实验条件下,S2-、HCOOH分别被KIO3氧化为SO42-、CO2。
Ⅰ组. H2S还原法,实验装置如图:

实验步骤如下:
①在上图所示的C中加入127g研细的单质I2和210g 30%的KOH 溶液,搅拌至碘完全溶解。
②打开弹簧夹向其中通入足量的 H2S。
③将装置C中所得溶液用稀H2SO4酸化后,置于水浴上加热10min。
④在装置C的溶液中加入BaCO3,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品145g。
Ⅱ组.甲酸还原法,实验装置如图:

实验步骤如下:
⑥在三颈瓶中加入 127g 研细的单质I2和210g 30%的 KOH 溶液,搅拌至碘完全溶解。
⑦通过滴液漏斗向反应后的溶液中滴加入适量HCOOH,充分反应后,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品 155g。
回答下列问题;
(1)图中装置 A 中发生反应的离子方程式为__________;装置 B 中的试剂是_________。
(2)D装置的作用是___________。
(3)步骤④的目的是_____________________ 。
(4)步骤⑤中“滤液用氢碘酸酸化”的目的是__________________ 。
(5)Ⅱ组实验的产率为__________________。
(6)Ⅱ组实验中,加入HCOOH发生氧化还原反应的离子方程式为_______________。
(7)与Ⅰ组相比较,Ⅱ组实验的优点是(至少答出两点即可)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关硅及其化合物的说法不正确的是
A.硅单质是常用的导体材料B.硅单质常被用于制造太阳能电池
C.玻璃能被氢氟酸刻蚀D.二氧化硅常被用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COOH)增大
B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C. 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com