
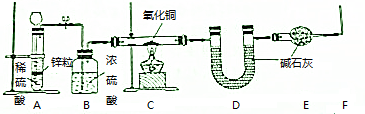
分析 根据装置图可知,题中实验的原理为用A装置产生氢气,经B装置干燥,通入C装置与氧化铜在加热条件下发生氧化还原反应生成水,水用碱石灰吸收,根据氧化铜的质量的变化和碱石灰的质量变化可确定氢元素和氧元素的质量比,据此推测水的组成,
(1)浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水,据此分析;
(2)由于氢气中混有空气会爆炸,所以加热C玻璃管之前必须排尽装置中的空气,尾气主要成分是氢气,从安全角度考虑,可以将氢气收集起来或点燃;
(3)如果拆去B装置,气体中的水蒸气进入装置C中的玻璃管会炸裂硬质玻璃管,氢气带入的水蒸气进入装置D吸收导致水的质量增大,对测定结果产生误差;
解答 解:根据装置图可知,题中实验的原理为用A装置产生氢气,经B装置干燥,通入C装置与氧化铜在加热条件下发生氧化还原反应生成水,水用碱石灰吸收,根据氧化铜的质量的变化和碱石灰的质量变化可确定氢元素和氧元素的质量比,据此推测水的组成,
(1)浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水,所以在浓硫酸中注入水可能会引起溶液瀑沸而产生危险,稀释浓硫酸的操作方法是先在烧杯中放入适量的水,然后将浓硫酸沿着烧杯内壁慢慢倒入水中,同时用不断用玻璃棒搅拌,
故答案为:可能会引起溶液瀑沸而产生危险;先在烧杯中放入适量的水,然后将浓硫酸沿着烧杯内壁慢慢倒入水中,同时用不断用玻璃棒搅拌;
(2)由于氢气中混有空气会爆炸,所以加热C玻璃管之前先在A装置中加入稀硫酸和锌粒,反应一段时间后在F处收集一小试管气体,用拇指堵住试管口,移至酒精灯上方,听声音,如果听到轻微的噗的声音,说明装置中氢气已经纯,可以在C处加热,尾气主要成分是氢气,从安全角度考虑,可以将氢气收集起来或在F处点燃,
故答案为:先在A装置中加入稀硫酸和锌粒,反应一段时间后在F处收集一小试管气体,用拇指堵住试管口,移至酒精灯上方,听声音,如果听到轻微的噗的声音,说明装置中氢气已经纯;将氢气收集起来或在F处点燃;
(3)如果拆去B装置,气体中的水蒸气进入装置C中的玻璃管会炸裂硬质玻璃管,引起安全隐患,从实验结果准确度分析,氢气带入的水蒸气进入装置D吸收导致水的质量增大,对测定结果产生误差,
故答案为:气体中的水蒸气进入装置C中的玻璃管会炸裂硬质玻璃管;氢气带入的水蒸气进入装置D吸收导致水的质量增大,对测定结果产生误差;
点评 本题主要考查实验基本操作和实验原理的分析,有一定的综合性,能够培养学生分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| C. | 氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O | |
| D. | 铁屑溶于稀硫酸溶液:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)可能为0.01 mol/L | B. | c(OH-)可能为1×10-12mol/L | ||
| C. | 该溶液不可能是酸溶液 | D. | 该溶液可能是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O═2NaOH | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Na2CO3+2HCl═2NaCl+CO2↑+H2O | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时甲烷与氧气的体积比为2:1 | |
| B. | 此时混合气体的平均相对分子质量约为26.7 | |
| C. | 此时混合气体中C、H、O原子的个数比为1:4:2 | |
| D. | 应在较为密闭的环境中使用瓦斯炉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用如图装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 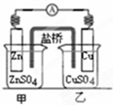 如图装置的盐桥中KCl的Cl-移向乙烧杯 | |
| C. |  如图装置中钢闸门应与外接电源的负极相连获得保护 | |
| D. |  装置中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾的相对原子质量较大 | |
| B. | 钾的密度比钠小 | |
| C. | 钾的原子半径大,失去电子的能力强 | |
| D. | 钾比钠与水反应更剧烈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com