
室温下,用含 0.2mol NaOH的溶液恰好吸收0.2mol NO2后得1L溶液,反应的化学方程式为:2NO2+2NaOH→NaNO3+NaNO2+H2O.对反应后的溶液,下列说法正确的是(已知:Ka(HNO2)=7.1×10﹣4、Ka(CH3COOH)=1.7×10﹣5)( )
|
| A. | n(NO2﹣)+n(OH﹣)﹣n(H+)=0.1 mol |
|
| B. | 若通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) |
|
| C. | 若加入少量CH3COONa固体,溶液的碱性会减弱 |
|
| D. | 此时溶液的pH大于0.1 mol/L的CH3COONa溶液 |
| 化学方程式的有关计算. | |
| 专题: | 计算题. |
| 分析: | A、根据溶液中的电荷守恒来计算回答; B、亚硝酸钠可以和盐酸之间发生反应,符合强酸制弱酸的原理; C、醋酸钠溶液显示碱性,碱性强于亚硝酸钠; D、醋酸钠溶液显示碱性,碱性强于亚硝酸钠. |
| 解答: | 解:A、根据反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,对反应后的溶液存在电荷守恒:n(NO3﹣)+n(NO2﹣)+n(OH﹣)=n(Na+)+n(H+),其中硝酸钠是强酸强碱盐,硝酸钠中的n(NO3﹣)=n(Na+),所以剩余的亚硝酸钠溶液中,n(NO2﹣)+n(OH﹣)﹣﹣n(H+)=n(Na+)=0.1 mol,故A正确; B、根据反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,硝酸钠显示中性,亚硝酸钠显示碱性,若通入0.01 mol HCl气体,亚硝酸钠可以和盐酸之间发生反应生成氯化钠和亚硝酸,亚硝酸酸性弱于盐酸,溶液pH大于2,故B正确; C、若加入少量CH3COONa固体,醋酸钠溶液显示碱性,溶液的碱性会增强,故C错误; D、Ka(HNO2)=7.1×10﹣4、Ka(CH3COOH)=1.7×10﹣5,醋酸酸性弱于亚硝酸,所以醋酸根离子水解程度大,0.1 mol/L的亚硝酸钠溶液溶液的pH小于0.1 mol/L的CH3COONa溶液,故D错误. 故选AB. |
| 点评: | 本题涉及盐的水解原理应用以及溶液中离子浓度之间的关系知识,注意知识的归纳和梳理是解题的关键,难度中等. |


科目:高中化学 来源: 题型:
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO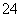 )=0.8 mol·L-1,则c(K+)为 ( )
)=0.8 mol·L-1,则c(K+)为 ( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究氨水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氨水有刺激性气味,说明氨水中含有氨气。
B.向氨水中滴加酚酞试剂,溶液变红,说明氨水中含有OH-
C.向氨水中加入浓氢氧化钠溶液,加热产生使湿润的淀粉碘化钾试纸变蓝的气体,说明氨水中含有NH4+
D.浓氨水和浓盐酸靠近产生大量白烟,说明氨气与氯化氢容易反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对应关系正确的是( )
| A | CH3CH3+Cl2CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油; 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br‾═2Cl‾+Br2; Zn+Cu2+═Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O+4NaOH+O2↑;Cl2+H2O═HCl+HClO | 均为水作还原剂的氧化还原反应 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
|
| A. | 图中N表示HA,P表示OH﹣,Q表示H+ | B. | 若V=10 mL,则pH=7 |
|
| C. | 若V<10 mL,则溶液显酸性 | D. | 若V=10 mL,则:c(M)+c(P)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
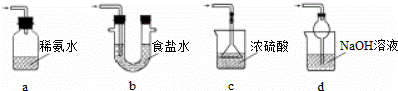
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
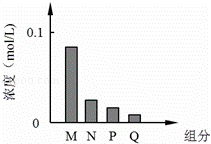
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为 (填序号)
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是 .
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 .
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g•L﹣1.
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 (填“偏高”“偏低”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。

(1)T的原子结构示意图是________。用化学方程式表示工业上常用于冶炼T单质的原 理是________________________________________ ________________________________。
理是________________________________________ ________________________________。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中的共价键类型是________。
(3)元素的非金属性:Q________W(填“强于”或“弱于”),结合方程式简述其原因是________________。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应的水化物,实验步骤:将盛有甲的试管倒扣在水槽中,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在密闭容器中,能 表示反应X(g)+2Y(g)
表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com