
| A. | 空气、硫酸铜、H2SO4 | B. | HCl、Fe(OH)3胶体、纯碱 | ||
| C. | 二氧化碳、胆矾、氢氧化钾 | D. | HNO3、食盐水、烧碱 |
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:填空题
(1)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C。下列物质含有丰富维生素C的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素是 ( 填字母)
A.碘 B.铁 C.钙
③蛋白质是人体必需的营养物质,它在人体内最终分解为 (填字母)。
A.葡萄糖 B.氨基酸 C. 脂肪酸
脂肪酸
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 。
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为 。
③铁是人们生活中常用的金属材料,请列举两种防止铁制品被腐蚀的方法: , 。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①空气质量报告的各项指标可以反映出各地的空气质量。下列各项中目前未列入我国空气质量报告的是 (填字母 )。
)。
A.SO2
B.NO2
C.CO2
D.PM2.5
E.氯氟烃
②垃圾应分类收集。以下物质应放置于贴有“ ”标志垃圾筒的是 (填字母)。
”标志垃圾筒的是 (填字母)。
A.废电池 B.废铝制的易拉罐 C.建筑固弃物、渣土
③pH< 的雨水称为酸雨;向煤中加入适量的 ,可以大大减少燃物产物中SO2的量。
④天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是  。
。
⑤对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
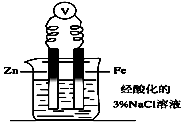
| A. | 将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 | |
| B. | 将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 | |
| C. | 向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 | |
| D. | 向图中烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大铁的量可以使反应速率加快 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 每生成1molH2,转移的电子数约为4×6.02×1023 | |
| D. | 该反应条件下铁的金属性比钠强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:简答题
(1)对于下列反应:2SO2+O2 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
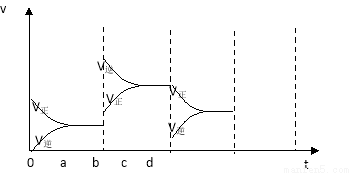
(2)下图左表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.
2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
将一定量的SO2和O2充入一个容积固定的密闭容器中,在一定条件下发生反应:2SO2+O2 2SO3,下列哪个量不再变化时,并不能说明化学反应已达到平衡状态( )
2SO3,下列哪个量不再变化时,并不能说明化学反应已达到平衡状态( )
A.混合气体的密度 B.混合气体的压强
C.混合气体的平均摩尔质量 D.SO2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com