
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出热量如图所示。
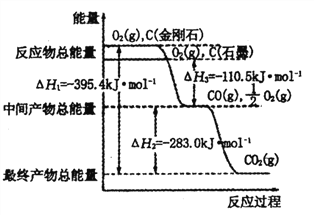
(1)等量的金刚石和石墨完全燃烧,________ (填“金刚石”或“石墨”)放出热量更多,石墨的燃烧热△H= ______________。
(2)12 g石墨在一定量的空气中燃烧, 生成气体36g,该过程放出的热量为_____________。
(3)已知:断开1 mol N2和1 mol 02分子中化学键所需要吸收的能量分别为946 kJ 和 497 kJ;N2(g) + O2(g)=2NO(g) △H=+180 kJ·mol-1 ,则相同条件下破坏NO分子中化学键释放的能量为_________。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:________。
【答案】 金刚石 -393.5kJ·mol-1 252.0kJ 631.5kJ 2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-746.0kJ·mol-1
【解析】(1)图象分析金刚石能量高于石墨,结合盖斯定律可知,完全燃烧金刚石放出的热量更多;图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为(110.5+283.0)kJ=393.5kJ,则石墨的燃烧热为393.5kJmol-1;
(2)12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ;C(石墨,s)+![]() O2(g)═CO(g)△H=-110.5kJmol-1 ;生成二氧化碳和一氧化碳混合气体放出热量=393.5kJmol-1 ×0.5mol+110.5 kJmol-1 ×0.5mol=252kJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
O2(g)═CO(g)△H=-110.5kJmol-1 ;生成二氧化碳和一氧化碳混合气体放出热量=393.5kJmol-1 ×0.5mol+110.5 kJmol-1 ×0.5mol=252kJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
(3)根据N2、O2分子中化学键的键能分别是946kJmol-1、497kJmol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJmol-1可设NO分子中化学键的键能为x,则有:946kJmol-1+497kJmol-1-2x=180kJmol-1 得:x=631.5kJmol-1;
(4)已知①C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ,
②C(石墨,s)+![]() O2(g)═CO(g)△H=-110.5 kJmol-1,
O2(g)═CO(g)△H=-110.5 kJmol-1,
③N2(g)+O2(g)=2NO(g)△H=+180kJmol-1,
由盖斯定律:方程式①×2-②×2-③得 2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.0kJmol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(mol·L-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________(只要求写表达式,不需计算)mol·L-1。
(2)配制过程中,下列操作配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 ![]() 的说法正确的是( )
的说法正确的是( )
A. 所有碳原子不可能都在同一平面上
B. 最多只可能有9个碳原子在同一平面上
C. 有7个碳原子可能在同一直线上
D. 至少有14个原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,始终无明显现象的是
A. NH3通入AlCl3溶液中
B. SO2通入HNO3酸化的Ba(NO3)2溶液中
C. NO2通入FeSO4溶液中
D. CO2通入CaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质。
(1)实验一:氢氧化钠标准溶液的配制。
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和______,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏_(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数。设计实验方案,将待测物理量和对应的测定方法填写在下表中。
待测物理量 | 测定方法 |
①_______ | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据。重复滴定2次。 |
②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用______测定溶液pH。 |
③ 上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为____________。
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响。
① 设计实验方案如下表,表中c=_______g。
编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
l | 乙酸 | 0.5 | 17.0 | 2.0 |
2 | 盐酸 | 0.5 | 17.0 | c |
② 实验步骤:
a)下图的装置中,在添加药品之前必须________;
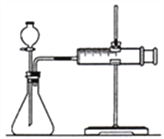
b)反应开始后,__________;
c)将所记录的欲据绘制成曲线图(下图)。

③ 写出镁与乙酸溶液反应的离子方程式:_______________。
④ 描述O~5min盐酸与镁条反应的反应速率变化规律:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是有机物A、B的有关信息。
A | B |
①能使溴的四氯化碳溶液退色 ②比例模型为: ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: |
根据表中信息回答下列问题:
(1)写出在一定条件下,A生成高分子化合物的化学反应方程式_____________________________________________。
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=____时,这类有机物开始出现同分异构体。
(3)B具有的性质是____(填序号)。
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水
反应使之退色、⑥任何条件下不与氢气反应。
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是 ( )
 △H= -4.2 kJ/mol
△H= -4.2 kJ/mol
A. 反-2-丁烯和顺-2-丁烯具有相同的熔沸点
B. 顺-2-丁烯比反-2-丁烯更稳定
C. 反-2-丁烯和顺-2-丁烯的核磁共振氢谱都有两个峰
D. 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是( )
A.酸性:HClO4>H2SO4
B.Na、Mg与水反应,Na更剧烈
C.气态氢化物的稳定性:HF>HCl
D.向Na2SO3溶液中加盐酸,有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
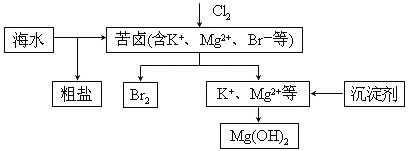
A. 向苦卤中通入Cl2是为了提取溴
B. 工业生产中常选用NaOH作为沉淀剂
C. 粗盐可采用除杂和重结晶等过程提纯
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用![]() 将其还原吸收
将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com