
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | CO2和NaCl | D. | F2和NaF |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,只能软化暂时硬水,不能软化永久硬水 | |
| D. | 只具有暂时硬度的水经加热煮沸后,可变成软水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Y2->Z+ | |
| B. | 气态氢化物稳定性:HW>H2R | |
| C. | XW4分子中各原子均满足8电子稳定结构 | |
| D. | Y、Z、R三种元素组成的化合物只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外界条件可以改变平衡状态 | B. | 达到平衡时正、逆反应速率相等 | ||
| C. | 平衡时各组分的含量也在不断变化 | D. | 该反应所建立的平衡是动态平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
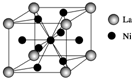 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
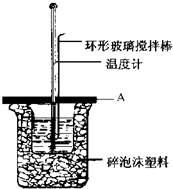 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
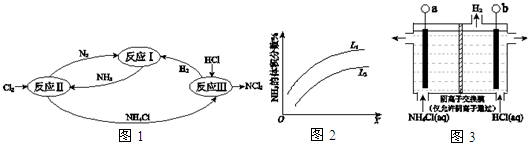
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com