
【题目】下列关于原子的认识正确的是( )
A.原子是构成一切物质的最小微粒
B.原子是不可再分的一种微粒
C.原子是化学变化中的最小微粒
D.所有原子的原子核内均有质子和中子
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
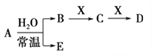
(1)元素⑧的最高价氧化物对应水化物的化学式是_________________________。
(2)元素⑤与As两种元素中,简单气态氢化物较稳定的是___________(填化学式)。
(3)元素②⑥⑦的简单离子半径由大到小的顺序是___________(用化学符号表示)。
(4)元素③的单质与元素②的最高价氧化物对应的水化物反应的离子方程式是________________。
(5)若A为红棕色气体,则X、D的化学式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是____mol/L,含NaOH的质量____g。
(2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则:
①混合气体的密度是_____。
②混合气体的平均摩尔质量是______。
③CO2和CO的体积之比是_______。
④CO的体积分数是______。
⑤CO2和CO的质量之比是_______。
⑥CO的质量分数是______。
⑦混合气体中所含氧原子的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )

①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-=Cu2+,发生氧化反应
A. ①②③B. ②④⑥
C. ②④D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸦片具有复杂的组成,其中的罂粟碱的分子结构如图。鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短。已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是
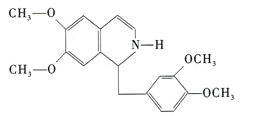
A. 23.75 mol;5 B. 24.5 mol;7 C. 24.5 mol;8 D. 23.75 mol;4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是( )
A. 稀硫酸 B. CuSO4 C. AgNO3 D. Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列说法正确的是( )
A. 1mol乙烷中含有的共价键数目为6NA
B. 14g乙烯中含有的C-H键数目为2NA
C. 0.1molFe与0.1molCl2充分反应,转移的电子数月为0.3NA
D. 0.1molCH4与0.1molCl2经光照充分反应,生成CH3Cl的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向______极移动(填“正”或“负”)。
②电子流动方向由_____极流向______极(填:“正”、“负”)。
③若有1mol e-流过导线,则理论上负极质量减少______g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是_____(填“锌极”或“铜极”),原因是_______(用电极方程式表示)。
(2)氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是碱性燃料电池,则正极反应方程式是_____。
(3)一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
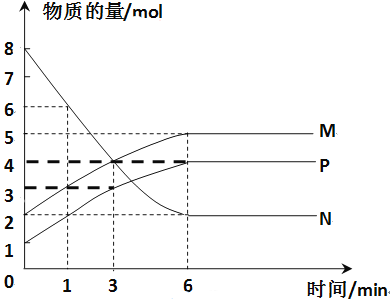
①反应化学方程式中各物质的系数比为a∶b∶c=____。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:______。
③下列叙述中能说明上述反应达到平衡状态的是_____。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是__________________。
(2)金属镁可以用来生产金属铀(元素符号是U):UF4+2Mg![]() U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
实验1 | 实验2 |
|
|
钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性_________>_________>_________(填元素符号),用原子结构理论解释:同周期元素从左到右,_________。
(4)把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,AB段速率增大的主要原因是__________________。
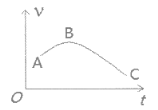
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com