
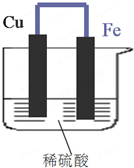
 如图所示,将铁、铜通过导线相连,置于稀硫酸中.
如图所示,将铁、铜通过导线相连,置于稀硫酸中.分析 (1)铁比铜活泼,Fe易失电子作负极,负极上电极反应式为Fe-2e-=Fe2+;
(2)Cu作正极,发生还原反应,正极上电极反应式为2H++2e-=H2↑,正极上有气泡产生;
(3)根据电极反应式Fe-2e-=Fe2+,若导线中通过了0.4mol电子,则反应的铁为0.2mol,所以质量为0.2mol×56g/mol=11.2g;依据化学方程式结合三段式列式,速率之比等于对应物质的化学计量数之比,来求A、C的速率和反应开始时B的浓度.
解答 解:(1)该原电池中,Fe易失电子作负极、Cu作正极,负极上电极反应式为Fe-2e-=Fe2+,故答案为:负;Fe-2e-=Fe2+;
(2)Cu作正极,发生还原反应,正极上电极反应式为2H++2e-=H2↑,导致负极上金属逐渐减少,正极上有气泡产生,故答案为:有气泡产生;还原;
(3)根据电极反应式Fe-2e-=Fe2+,若导线中通过了0.4mol电子,则反应的铁为0.2mol,所以质量为0.2mol×56g/mol=11.2g;
依据化学方程式结合三段式列式,
A(g)+2B(g)?3C(g);
起始量(mo/L) 1.0
变化量(mol/L)0.2 0.4 0.6
2min后(mol/L)0.8 1.2
则V(A)=$\frac{△c}{△t}$=$\frac{0.2}{2}$=0.1mol/(L•min),根据速率之比等于对应物质的化学计量数之比,所以V(C)=3×0.1mol/(L•min)=0.3mol/(L•min),开始时B的浓度等于1.2+0.4=1.6mol/L,故答案为:11.2;0.1mol/(L•min);0.3mol/(L•min);1.6mol/L.
点评 本题考查原电池的反应原理和化学反应速率的相关计算,难度不大.要注意平衡三段式的应用.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池为一次性电池,内部的氧化还原反应是不可逆的 | |
| B. | 铜锌稀硫酸原电池在使用时,电解质溶液中的阳离子向负极移动 | |
| C. | 锌锰干电池的正极发生氧化反应:Zn-2e-=Zn2+ | |
| D. | 电解质溶液导电和金属导电一样,是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、HCO3-、AlO2- | ||
| C. | NO3-、K+、AlO2-、OH-? | D. | NO3-、Mg2+、K+、CH3COO-? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,4-三甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

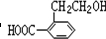
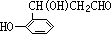 ;
;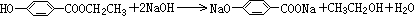 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿疏松透气的土壤中 | B. | 在干燥致密不透气的土壤中 | ||
| C. | 在含铁元素较多的酸性土壤中 | D. | 在含碳粒较多,潮湿透气的土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com