
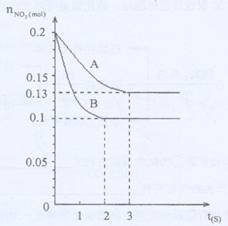
 ���ݻ�ΪVK���ܱ������з���2NO2
���ݻ�ΪVK���ܱ������з���2NO2 2NO+O2�ķ�Ӧ����Ӧ������NO2�����ʵ��� ��ʱ��仯��״����ͼ��ʾ��
��1��������A��B��ʾ���Ǹ÷�Ӧ��ij��ͬ�����µķ�Ӧ״������ò�ͬ�����ǣ� ��
A���С�����B���¶Ȳ�ͬC��ѹǿ��ͬD��Vֵ��ͬ
��2��д���÷�Ӧ�Ļ�ѧƽ�ⳣ��K�ı���ʽ �����Ƚ�K800�� K850������>��<��=����
��3����ͼ��������A������NO�ı仯���ߣ���������B�����´ӷ�Ӧ��ʼ���ﵽƽ�⣬�����ķ�Ӧ����VO2= ��
��4������˵���÷�Ӧ�Ѵﵽƽ��״̬���� �� ��
A��V����NO2��=V�棨NO�� B��C��NO2��=C��NO��
C�������ƽ��Ħ���������� D��������ܶȱ��ֲ���
��1��B
��2��![]() <
<
��3��![]()
��4��BD
���⿼�黯ѧƽ�⡣��1����ͼ�εó�����Ϣ��ƽ��״̬��ͬ��B״̬��Ӧ���ʴ���A״̬���ȴﵽƽ�⣬A״̬��ƽ��Ũ�ȴ���B״̬��˵����A״̬��B״̬��ƽ�������ƶ�����֪�÷�Ӧ�����ȷ�Ӧ������������С�����������¶ȡ���Сѹǿ�ܹ�ʹƽ�������ƶ������Ǽ�Сѹǿ����Ӧ���ʼ�С����ͼ�β�������Bѡ����ȷ����2���¶�Խ�ߣ�KԽ��3��B�����´ӷ�Ӧ��ʼ���ﵽƽ��ʱ����2�룬��n(NO2)=0.1mol�����n(O2)=0.05mol�����ΪV������v (O2)=![]() mol/(L��s)����4���ڷ���ʽ�����࣬Ӧ����ͬʱ���ɻ�ͬʱ���ģ�Aѡ����ȷ��״̬�Ƿ�ﵽƽ�������ʵ�Ũ���أ�Bѡ����÷�Ӧ�Ǵ�����ķ�Ӧ����������������䣬�����ʵ����DZ仯�ģ����������ƽ��Ħ������������Ϊ�����Ƿ�ﵽƽ��ı�־��Cѡ����ȷ����������������䣬�����Ҳ���䣬���ܶ�������ʱ�̶����䣬Dѡ�����
mol/(L��s)����4���ڷ���ʽ�����࣬Ӧ����ͬʱ���ɻ�ͬʱ���ģ�Aѡ����ȷ��״̬�Ƿ�ﵽƽ�������ʵ�Ũ���أ�Bѡ����÷�Ӧ�Ǵ�����ķ�Ӧ����������������䣬�����ʵ����DZ仯�ģ����������ƽ��Ħ������������Ϊ�����Ƿ�ﵽƽ��ı�־��Cѡ����ȷ����������������䣬�����Ҳ���䣬���ܶ�������ʱ�̶����䣬Dѡ�����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 Z��g��+M��s����5min��ﵽƽ�⣬��ʱ����a molZ������˵����ȷ���ǣ�������
Z��g��+M��s����5min��ﵽƽ�⣬��ʱ����a molZ������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��16.7% | B��50% | C��66.7% | D��83.3% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com