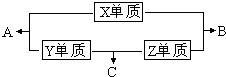
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而M的单质在常温常压下为固体,并且M元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置
第2周期第ⅥA族
第2周期第ⅥA族
.
(2)化合物C在一定条件下生成化合物A的化学方程式
.
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,得到pH=5的溶液,反应后的溶液存在的平衡体系有
NH4++H2O?NH3?H2O+H+;H2O?OH-+H+;
NH4++H2O?NH3?H2O+H+;H2O?OH-+H+;
;溶液中离子浓度由大到小的顺序为
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.
(4)实验室里为制取C,常在C的浓溶液中加入生石灰.请叙述产生C的原因
氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
.
(5)已知Y单质和Z单质生成C的反应是可逆反应,△H<0.将等物质的量的单质Y和单质Z充入一密闭容器中,在适当催化剂和恒温条件下反应.下列说法中正确的是
ab
ab
a.达到化学平衡时,正反应与逆反应速率相等
b.反应过程中,单质Y的体积分数始终为50%
c.达到化学平衡时,Y单质和Z单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡时,再升高温度,C的体积分数增大
(6)由X、Z、M三种元素可以形成化合物M
2Z
6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则发生的有关化学方程式为
CH
3CH
2OH+CuO
CH
2CHO+Cu+H
2O
CH
3CH
2OH+CuO
CH
2CHO+Cu+H
2O
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化: