
在一定条件下,可逆反应X(g)十3Y(g) 2Z(g)达到平衡时,X的转化率与Y的转化率之比为1∶2,则起始充入容器中的X与Y的物质的量之比为
2Z(g)达到平衡时,X的转化率与Y的转化率之比为1∶2,则起始充入容器中的X与Y的物质的量之比为
A.1∶1 B.1∶3 C.2∶3 D.3∶2
科目:高中化学 来源:2014-2015学年江苏丹阳中学高二上10月月考化学试卷(解析版) 题型:推断题
(10分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有___________个原子共平面;
(2)金刚烷的分子式为___________,其分子中的CH2基团有___________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
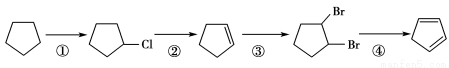
其中,反应①的产物名称是____ ____,反应③的反应类型是___ ____;
(4)已知烯烃能发生如下反应:

请写出下列反应产物的结构简式:
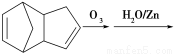 ______________ _____。
______________ _____。
查看答案和解析>>
科目:高中化学 来源:2016届四川省成都市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
化学与人类生产、生活密切相关,下列有关说法正确的是
A.工业上用惰性电极电解熔融的MgO可制得Mg
B.为加快漂白精的漂白速率,使用时可滴加几滴醋酸
C.草木灰可与铵态氮肥混合施用
D.氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:选择题
在下列反应中,生成物的能量总和高于反应物的能量总和且表述正确的是
A.Zn(s) + H2SO4(aq) = ZnSO4(aq) + H2↑(g) ΔH<0
B.2CO(g)+ O2(g) =2CO2(g) ΔH<0
C.C(s) + CO2(g) = 2 CO(g) ΔH>0
D.H+(aq)+ OH-(aq)= H2O (l) ΔH>0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:填空题
在恒温、恒容的1L密闭容器中,混合气体X、Y、Z的物质的量n与时间t 的关系如下表所示:X(g)+3Y(g) 2Z(g) △H <0
2Z(g) △H <0
t/ min n/ mol | 0min | 2min | 4min | 6min | 8min |
n(X) | 0.2 | 0.15 | 0.1 | 0.1 | 0.05 |
n(Y) | 0.6 | 0.45 | 0.3 | 0.3 | 0.5 |
n(Z) | 0 | 0.1 | 0.2 | 0.2 | 0.3 |
(1)第6min末改变了什么条件到达第8分钟的平衡状态: 。
(2)在相同温度下,若1L容器为体积可变的密闭容器,充入0.2mol X 、0.6molY,达到平衡时n(Z)=bmol ,则b 0.2(填“<”、“>”或“=”),平衡时容器的体积V = (用含b的式子表示)
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的物质的量
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的体积分数 (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期10月月考化学试卷(解析版) 题型:填空题
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
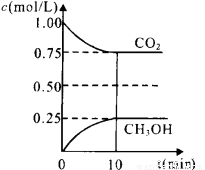
①能说明该反应已达平衡状态的是__________(填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:推断题
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
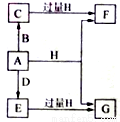
(1)A所含元素在周期表中的位置为 ,C的电子式为 。
(2)A与H在加热条件下反应的离子方程式为 。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为 。
(4)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:填空题
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为____________。
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=____________。
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:______________。
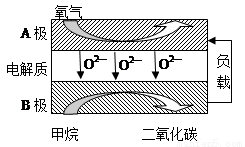
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池____________极,电极反应式为________________。
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为______________(标准状况下),实际上消耗的甲烷体积(折算到标准状况)比理论上大,可能原因为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:选择题
下列化学变化中,需加入氧化剂才能实现的是
A.C→CO2 B.CO2→ CO C.CuO→Cu D.H2SO4→BaSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com