
分析 (1)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;
(2)依据n=$\frac{m}{M}$计算NO2的物质的量,反应热与NO2的物质的量成正比,根据热化学方程式的书写方法书写,注意物质的聚集状态和反应热的单位等问题;
(3)根据盖斯定律:①C(s)+O2(g)=CO2(g)△H=-394 kJ/mol,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol,
③C (s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111 kJ/mol,
根据盖斯定律,①-②-③得.
解答 解:(1)0.5mol辛烷完全燃烧生成CO2和液态水时放热2759kJ,则1mol汽油完全燃烧放热=2×2759kJ=5518KJ,该反应的热化学方程式为C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol,
故答案为:C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol;
(2)23克NO2的物质的量n=$\frac{m}{M}$=$\frac{23g}{46g/mol}$=0.5mol,适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1;
(3)①C(s)+O2(g)=CO2(g)△H=-394 kJ/mol,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol,
③C (s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111 kJ/mol,
根据盖斯定律,①-②-③得:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-42kJ/mol.
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-42kJ/mol.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,同时还考查了盖斯定律,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
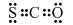 ;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol
;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol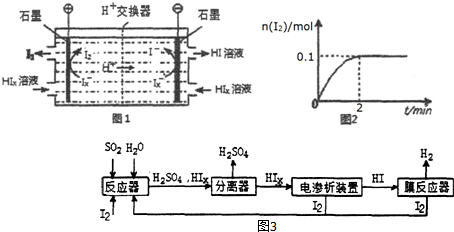
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.
甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
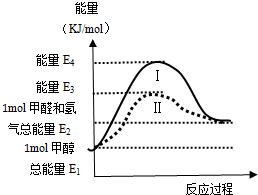
 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单气态氢化物沸点Y>X>W | |
| B. | 原子半径Z>Y>X>W | |
| C. | Y元素可能位于第二周期第ⅦA族 | |
| D. | Y元素与其它三种元素均可形成多种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 再加300mL 1 mol•L-1盐酸 | ||
| C. | 用等量铁片代替铁粉 | D. | 改用100mL 98%的硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com