
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:________________
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是___________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ mol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
H2O(l)=H2O(g) △H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) 的 △H=____________
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:____________________
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
还原产物的化学式为________________
②配平后的化学方程式是____________________
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
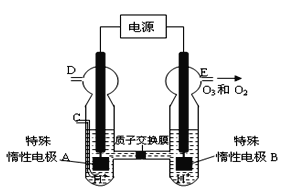
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
【答案】(1)H2O2+2I-+2H+==I2+2H2O
(2)![]() (3)-555.28kJ mol-1
(3)-555.28kJ mol-1
① KOH ②O3+2KI+H2O=2KOH+I2+O2
(4)① A ② 50% ③O2+4H++4e-=2H2O
【解析】
试题分析:(1)酸性条件下H2O2氧化碘化钾生成碘单质和水,反应的离子方程式为H2O2+2I-+2H+==I2+2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,过氧化钡是离子化合物,电子式为:![]() 。
。
(3)已知:反应①N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ mol-1
反应②H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
反应③H2O(l)=H2O(g) △H=+44kJ mol-1
根据盖斯定律可知,①+②×2+③×4即得到N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)
△H=-534kJ·mol—1-98.64kJ·mol—1×+44kJ·mol—1×4=-555.28kJ·mol—1。
(3)①该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物;②碘元素化合价-1价变化为0价,氧元素化合价变化为-2价,结合电子守恒配平书写化学方程式为O3+2KI+H2O=2KOH+I2+O2;
(4)①由图可知,B极生成O2、O3,B极发生氧化反应,电解池阳极发生氧化反应,A为阴极,电极反应为2H++2e-═H2↑,答案为A;②若C处不通入O2,实质为电解水,D处为氢气,体积为11.2 L,物质的量为0.5mol,E处为氧气、臭氧,体积共为4.48L,物质的量为0.2mol,令臭氧的体积为xL,根据电子转移守恒有0.5×2=x×3×2+(0.2-x)×2×2,解得x=0.5mol-2×0.2mol=0.1,所以E处收集的气体中O3所占的体积分数为0.1mol÷0.2mol×100%=50%。③C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,用该电池电解100mL 硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.02mol电子时,B装置两极共收集到0.224L气体(标准状况)。下列说法正确的是( )
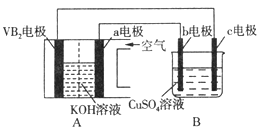
A. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
B. VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
C. 电池内部OH-移向a电极,溶液pH保持增大
D. 忽略溶液体积变化,电解后B装置中溶液的pH为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
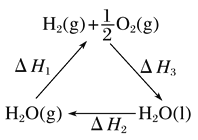
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 如图中ΔH1=ΔH2+ΔH3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.升高温度,Al2(SO4)3溶液的pH增大。
B.室温下,CuSO4溶液pH<7,因此向纯水中加入CuSO4会抑制水的电离。
C.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2。
D.相同温度下,AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 在食品袋中放入CaCl2·6H2O,可防止食物受潮
B. 硅是制造太阳能电池的常用材料
C. 四氧化三铁俗称铁红,可用作油漆、红色涂料
D. SO3溶于水形成的溶液能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氨能被Cl2、Br2、H2O2等氧化,已知以下反应:8NH3+3Cl2→6NH4Cl+N2
已知该反应中,氨气不足时,也会有HCl产生。
(1)用单线桥标出电子转移的方向和数目。________
(2)这一反应中,氧化剂是________,氧化产物是________。
(3)若有3 mol N2生成,则发生氧化反应的物质有________mol。
(4)根据上述反应,若将浓氨水与Cl2靠近,将会看到______________________(现象)。
(5)当0.5LNH3与0.3LCl2充分反应后,气体的体积变为________L,若收集一瓶该产物气体,并使用该气体进行喷泉实验,并用紫色石蕊溶液作指示剂,最终溶液呈________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中。

①ⅡA族元素的最外层电子数__________。
②第三周期元素的最高正价__________。
③F-、Na+、Mg2+、Al3+的离子半径__________。
(2)用A+、B-、C2-、D分别表示含有18电子的4种微粒(离子或分子)
①A+、B-、C2-半径由大到小顺序为__________。(填离子符号)
②D分子中含有4个原子,其电子式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向H2C2O4溶液中逐滴加入NaOH溶液,所得溶液中H2C2O4,HC2O4-,C2O42-三者物质的量分数(分布系数)随pH变化的关系入左图所示。右图为不同浓度NaHC2O4溶液中部分微粒浓度。下列表述错误的是
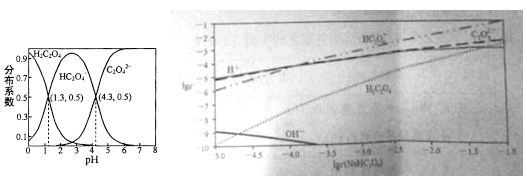
A. HC2O4-![]() H++C2O42- K=1×10-4.3
H++C2O42- K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. NaHC2O4溶液中一定存在c(C2O42-)>c(H2C2O4),同时c(H+)>c(OH-)
D. 在0.1mol/L NaHC2O4溶液中各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com