
| 1 | A | |||||||||||||||||
| 2 | B | |||||||||||||||||
| 3 | C | D | E | F | G | H | I | |||||||||||
| 4 | J | K | ||||||||||||||||
| 5 | ||||||||||||||||||
| 6 | ||||||||||||||||||
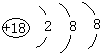 .
. ;它的空间构型是正四面体.
;它的空间构型是正四面体.分析 由元素在周期表中位置,可知A为氢、B为碳、C为Na、D为Mg、E为Al、F为磷、G为硫、H为Cl、I为Ar、J为Fe、K为Br.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;
(2)氢氧化铝是两性氢氧化物,C最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;非金属性越强,对应氢化物越稳定;
(4)A和B可形成最简单的有机化合物为CH4;
(5)非金属性越强,对应单质氧化性越强;
(6)氧化铁与CO反应生成Fe与二氧化碳.
解答 解:由元素在周期表中位置,可知A为氢、B为碳、C为Na、D为Mg、E为Al、F为磷、G为硫、H为Cl、I为Ar、J为Fe、K为Br.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,原子核外电子数为18,原子结构示意图为: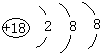 ,
,
故答案为:Ar;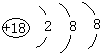 ;
;
(2)Al元素的氢氧化物--氢氧化铝是两性氢氧化物,C最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)金属性Na>Mg>Al,故最高价氧化物对应水化物中NaOH的碱性最强;非金属性越强P<S<Cl,氢化物越稳定与元素非金属性一致,故HCl最稳定,
故答案为:NaOH;HCl;
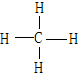
(4)A和B可形成最简单的有机化合物为CH4,结构式为 ,为正四面体结构,
,为正四面体结构,
故答案为: ;正四面体;
;正四面体;
(5)非金属性Cl>Br,非金属性越强,对应单质氧化性越强,故氧化性:Cl2>Br2,
故答案为:Br2;
(6)氧化铁与CO反应生成Fe与二氧化碳,反应方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 本题考查元素周期表与元素周期律,熟练掌握元素周期表的结构,(6)中方程式书写为易错点,必修中不涉及工业高炉炼铁.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为4NA | |
| C. | 常温常压下,15g乙烷分子中含有的碳氢键数目为3 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部正确 | B. | 只有①⑤正确 | ||
| C. | 只有③正确 | D. | 以上说法都是错误的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
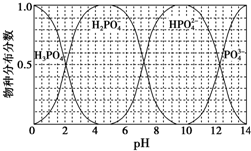 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH | B. | CH2=CH2 | C. | CH2=C(CH3)CH3 | D. | CH≡C-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com