
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如下图所示:

(1)该反应为_______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_________极(填“正”或“负”)。铜片上产生的现象为_________,外电路中电子由________电极(填“Fe”或“Cu”,下同),向________电极移动。
(4)若依据氧化还原反应:Cu2++Fe=Cu+Fe2+设计的原电池如下图所示,请回答下列问题:

电极X的材料是________,电解质溶液Y是_________,X电极上发生的电极反应式为_________。
【答案】放热 AC 正 产生无色气泡 Fe Cu Fe CuSO4 或CuCl2、Cu(NO3)2等 Fe-2e-=Fe2+
【解析】
(1)图中反应物总能量大于生成物总能量,则金属与酸的反应为放热反应;
(2)增大接触面积、增大反应物浓度、升高温度均可加快反应速率;
(3)Fe失去电子作负极,则Cu为正极,电子由负极流向正极;
(4) Fe失去电子被氧化,作原电池的负极,Cu2+得到电子发生还原反应,则含有Cu2+的溶液为电解质溶液,以此来解答。
(1)图中显示反应物总能量大于生成物总能量,因此该反应为放热反应;
(2)A.将改铁片为铁粉,增大了Fe与硫酸的接触面积,反应速率增大,A符合题意;
B.改稀硫酸为98%的浓硫酸,浓硫酸具有强氧化性,在室温下遇Fe发生钝化,阻止反应的进一步发生,且不生成氢气,B不符合题意;
C.升高温度,物质内能增加,有效碰撞次数增加,反应速率加快,C符合题意;
D.反应混合物中无气体物质,减小压强,对化学反应速率无影响,D不符合题意;
故合理选项是AC;
(3)由于Fe的活动性比Cu强,Fe失去电子被氧化,作原电池的负极,Cu为原电池的正极,则Cu片上溶液中的H+得到电子变为H2,电极反应式为2H++2e-=H2↑,因此Cu片上的现象产生无色气泡;外电路中电子由负极Fe向正极Cu移动;
(4)在反应:Cu2++Fe=Cu+Fe2+中,Fe失去电子,被氧化,Fe为原电池的负极,所以X应该是Fe电极,X电极反应式为:Fe-2e-=Fe2+;Cu2+得到电子,发生还原反应,因此电解质溶液Y应该是含有Cu2+的盐溶液,可以是CuSO4 或CuCl2、Cu(NO3)2等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同条件下进行合成氨反应。根据下列在相同时间内测定的结果判断生成氨的速率最快的是
A.v(H2)=0.1 mol·(L·min)-1B.v(N2)=0.1 mol·(L·min)-1
C.v(N2)=0.2 mol·(L·min)-1D.v(NH3)=0.3 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是
A.NH![]() 、Ba2+、HCO
、Ba2+、HCO![]() 、Cl-B.K+、Al3+、SO
、Cl-B.K+、Al3+、SO![]() 、ClO-
、ClO-
C.Na+、Fe3+、Cl-、SO![]() D.NH
D.NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的结构式___________,所含化学键类型为__________(填“非极性键”或“极性键”或“离子键,下同)。
(2)中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。
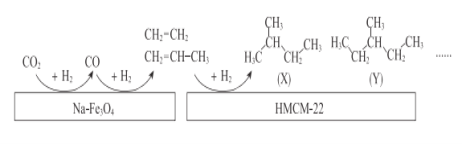
①Na-Fe3O4和HMCM-22 在反应中的作用为___________
②写出(X)的所有同分异构体结构简式___________
③关于X和Y的说法正确的是_______(填序号)。
A.最简式相同 B.都有4种一氯代物
C.都易使酸性KMnO4溶液褪色 D.X和Y互称同分异构体
(3)同温同压下,蒸气密度是氢气15倍的烷烃(M),写出烷烃(M)的结构简式____其与氯气反应生成一氯代烃的方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为___, 其离子结构示意图为:____。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为____。
(3)关于C、D 两种元素说法正确的是_________(填序号)
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(5)比较Y元素与其同族短周期元素的氢化物的稳定性 _______(填氢化物化学式),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F+Na3Ti2(PO4)3![]() 2Na2FePO4F+NaTi2(PO4)3
2Na2FePO4F+NaTi2(PO4)3
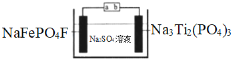
下列说法错误的是( )
A.充电时,a接电源负极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌纽扣电池,其电池的电池反应式为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
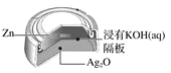
A.锌作负极
B.正极发生还原反应
C.电池工作时,电流从Ag2O经导线流向Zn
D.电池工作时,溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3B.0≤c2≤0.42
C.X、Y的转化率相等D.当反应达到平衡时,反应就停止了
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com