
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应的平衡常数Kp(100MPa)__Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为__(保留3位有效数字),Kp=__(MPa)-2(列出计算式)。
[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(3)科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极反应式为___。
②下列说法正确的是__(填标号)。
A.该装置用金(Au)作催化剂,目的是降低N2的键能
B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
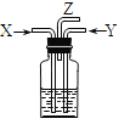
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜与过量浓硫酸反应的实验说法不正确的是( )
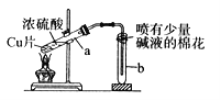
A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,11.2 LCH3Cl含极性键数目为2NA
B. 甲基的碳原子杂化轨道类型是sp2,每摩尔甲基含9NA电子
C. 等质量的葡萄糖和乙酸所含碳原子数均为NA/30
D. 有机物(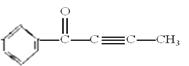 )中最多有6个原子在同一直线上
)中最多有6个原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T-carbon(又名T-碳),是中国科学院大学苏刚教授研究团队于2011年通过理论计算预言的一种新型三维碳结构,经过不懈的努力探索,2017年终于被西安交大和新加坡南洋理工大学联合研究团队在实验上成功合成,证实了理论预言。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体晶胞结构,如图。下列说法错误的是( )
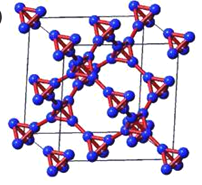
A. 每个T-碳晶胞中含32个碳原子
B. T-碳密度比金刚石小
C. T-碳中碳与碳的最小夹角为109.5°
D. 由于T-碳是一种蓬松的碳材料,其内部有很大空间可供利用,可能可以用作储氢材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达芦那韦”是抗击新型冠状病毒潜在用药,化合物Qs是它的合成中间体,其合成路线如图:
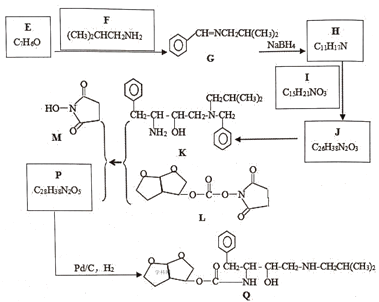
已知:R1CHO![]() R1—CH=N—R2
R1—CH=N—R2
(1)下列说法不正确的是__。
A.有机物E所有原子一定共平面
B.核磁共振、质谱、红外光谱等可用于测定有机物I的结构
C.H→J是加成反应
D.有机物Q分子式C21H33N2O5
(2)写出化合物H的结构简式__。
(3)写出K+L=M+P的化学方程式__。
(4)设计从苯甲醇和CH3NH2为原料制备![]() 的合成路线用流程图表示,无机试剂任选)__。
的合成路线用流程图表示,无机试剂任选)__。
(5)有机物R是相对分子质量比F大14的同系物。R的1H—NMR谱表明分子中有3种氢原子,写出R符合条件的所有同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)=SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是 ___。
(2)铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,请写出其水解反应化学方程式____。LiAlH4在化学反应中通常作_______(填“氧化”或“还原”)剂。工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为 _________
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
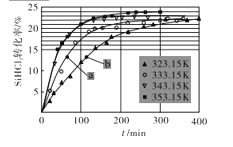
①353.15K时,平衡转化率为____,该反应是____反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的最佳措施是____。
(4)比较a、b处反应速率的大小:Va ___Vb (填“>”“<”或“=”)。已知反应速率V正=K1x2SiHCl3,V逆=K2xSiH2Cl2xSiCl4,K1,K2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时K1/K2 =____(保留3位小数)。
(5)硅元素最高价氧化物对应的水化物是H2SiO3,室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是 ___,其原因是____。已知:H2SiO3 :Ka1=2.0×10-10、Ka2=2.0×10-12、H2CO3 :Ka1=4.3×10-7,Ka2=5.6×10-11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com