
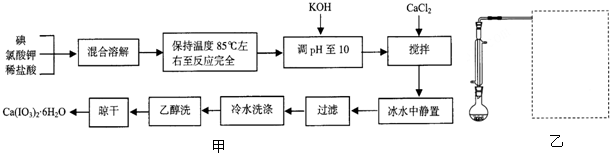
分析 I2与KClO3和HCl反应保持在85°C左右,反应生成KH(IO3)2、KCl和Cl2,调pH至10使加入氢氧化钾和碘酸氢钾反应生成KIO3,加入氯化钙会和碘酸钾发生反应生成碘酸钙,冰水中静置、过滤、洗涤、乙醇洗、晾干可得到Ca(IO3)2•6H2O.
(1)制备碘酸氢钾的反应过程中生成有毒气体氯气不能排放到空气中,需要用氢氧化钠溶液吸收;
(2)反应保持在85°C左右,需要水浴加热,加热有酒精灯,温度计;
(3)依据化学反应反应物、生成物特征性质分析判断,反应中只有碘单质有颜色,根据颜色变化判断反应是否完全;
(4)碘酸钙是微溶于水的物质,加入氯化钙可以生成碘酸钙沉淀;
(5)物质溶解度随温度升高增大,随温度降低减小,冰水中冷却有利于碘酸钙析出晶体.
解答 解:I2与KClO3和HCl反应保持在85°C左右,反应生成KH(IO3)2、KCl和Cl2,调pH至10使加入氢氧化钾和碘酸氢钾反应生成KIO3,加入氯化钙会和碘酸钾发生反应生成碘酸钙,冰水中静置、过滤、洗涤、乙醇洗、晾干可得到Ca(IO3)2•6H2O.
(1)中间产物碘酸氢钾的合成原理为:I2+2KClO3+HCl$\frac{\underline{\;\;△\;\;}}{\;}$KH(IO3)2+KCl+Cl2↑,反应过程中生成有毒气体氯气不能排放到空气中,需要用氢氧化钠溶液吸收,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:NaOH溶液;Cl2+2OH-=Cl-+ClO-+H2O;
(2)依据流程分析制备反应需要保持温度再85°C左右需要用水浴加热,用温度计控制温度高低,水浴需要的仪器有酒精灯、烧杯、温度计,故答案为:烧杯、温度计;
(3)I2+2KClO3+HCl$\frac{\underline{\;\;△\;\;}}{\;}$KH(IO3)2+KCl+Cl2↑,依据反应可知碘单质反应完全后生成无色物质,所以反应后溶液变化为无色证明反应完全,
故答案为:反应混合溶液变为无色;
(4))“调pH至10”的目的是加入氢氧化钾和碘酸氢钾反应生成KIO3,故答案为:将KH(IO3)2转化为KIO3;
(5)流程中加入氯化钙会和碘酸钾发生反应生成碘酸钙,发生的反应为:KIO3+CaCl2=Ca(IO3)2+2KCl,故答案为:KIO3+CaCl2=Ca(IO3)2+2KCl.
点评 本题考查了物质制备实验操作的分析判断,物质性质的分析,信息应用能力,流程分析判断是解题关键,注意知识积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Mg2+、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、Cl2 | D. | Na+、Ba2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
反应C(s)+H2O(g) CO(g)+H2(g)在一密闭容器中进行,下列说法或结论能够成立的是( )
CO(g)+H2(g)在一密闭容器中进行,下列说法或结论能够成立的是( )
A.当 v(CO)(正)=v(H2)(正)时,反应达平衡状态
B.其他条件不变,适当增加C(s)质量会使平衡正向移动
C.保持体积不变,充入少量He使体系压强增大,反应速率一定增大
D.其他条件不变仅将容器的体积缩小一半,再次平衡时H2O(g)的平衡浓度可能是原来的2.1倍
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在一个密闭容器中发生反应:2SO2(g)+O2(g) 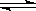 2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
A.c(SO3)=0.4mol/L
B.c(SO2)=c(SO3)=0.15mol/L
C.c(O2)=0.35mol/L
D.c(SO2)+c(SO3)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应熵判据起决定作用 | B. | 该反应焓判据起决定作用 | ||
| C. | 该反应是熵减的反应 | D. | 该反应是分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 反应物的总焓大于生成物的总焓时,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为1NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com