
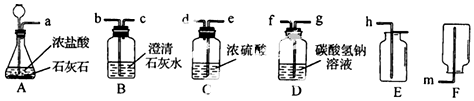
分析 ①根据装置内的药品来确定反应原理,盐酸的酸性强于碳酸,碳酸钙与盐酸发生复分解反应生成二氧化碳;
②根据浓盐酸具有挥发性来分析,CO2中混有HC1,不能生成CaCO3沉淀;
③根据浓硫酸具有吸水性,碳酸氢钠溶液能吸收氯化氢气体等知识进行分析.
解答 解:①盐酸的酸性强于碳酸,大理石的主要成分是碳酸钙,与盐酸反应时生成氯化钙、水和二氧化碳,反应方程式为:CaCO 3+2HCl═CaCl2+H2O+CO2↑,
故答案为:CaCO 3+2HCl═CaCl2+H2O+CO2↑;
②浓盐酸具有挥发性,导致制取的二氧化碳中混有氯化氢气体,氯化氢能与氢氧化钙反应,使CO2中混有HC1,不能生成CaCO3沉淀,
故答案为:浓盐酸挥发,使CO2中混有HCl,不能生成CaCO3沉淀;
③先用碳酸氢钠溶液除去二氧化碳中混有的氯化氢气体,再用浓硫酸除去二氧化碳的水蒸气,最后用向上排空气法来收集,注意气体的长进短出.
故答案为:g;f;e;d;h.
点评 本题考查二氧化碳的制备,注意浓盐酸具有挥发性,导致制取的二氧化碳中混有氯化氢气体为该题的解答关键点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲基的结构式: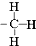 | B. | 硝基苯的结构简式: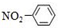 | ||
| C. | 氯乙烷的分子式:C2H5Cl | D. | 丙烷分子的球棍模型示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1mol二氧化硅中所含硅氧键数目为0.2NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 常温常压下,46gNO2含有原子数为3 NA(相对原子质量N:14 O:16) | |
| D. | 标准状况下,11.2LSO3含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水不能区别酒精、苯和四氯化碳 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 在用水吸收HCl气体时可把导管直接插入液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 5项 | C. | 6项 | D. | 7 项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,22.4LSO3含有原子数为4NA | |
| B. | 4℃时,18gH2O含有2NA 个非极性键 | |
| C. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| D. | 将含1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 粗盐提纯得到精盐的过程一定需要两次过滤操作 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
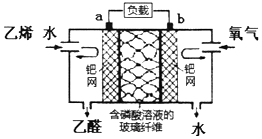
| A. | 该电化学装置是电解池 | |
| B. | a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 氧气在b极被氧化 | |
| D. | 电子移动方向:电极a→负载→电极b→磷酸溶液→电极a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com