
| A、简单离子半径大小顺序:rW>rZ>rY |
| B、元素W的氧化物对应水化物的酸性比Y的强 |
| C、X与Y形成的原子晶体X3Y4的熔点可能比金刚石高 |
| D、X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-6 | K a1=4.1×10-7 K a2=5.6×10-11 |
| A、相同浓度下CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+HClO |
| C、向0.1mol?L-1 CH3COOH溶液中滴加NaOH 溶液至恰好完全中和,离子浓度大小关系:c(Na+ )>c(CH3COO-)>c(OH-)>c(H+) |
| D、CO32-的水解常数与K a1的乘积为Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、Cd(OH)2 |
| B、Ni(OH)2 |
| C、Cd |
| D、NiO(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
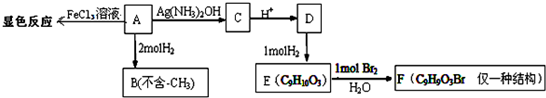
查看答案和解析>>
科目:高中化学 来源: 题型:

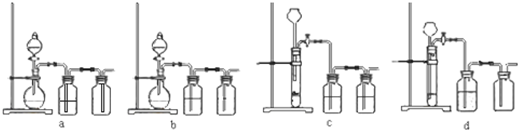
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取4.9gNaOH固体 |
| B、NaOH固体加蒸馏水溶解,要待溶液冷却到室温后,再转移至容量瓶中 |
| C、容量瓶不能用玻璃瓶塞、应用塑料瓶塞 |
| D、定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com