
【题目】某同学在实验室研究Fe与H2SO4的反应

【实验分析】
(1)实验I中,铁与稀硫酸反应的离子方程式为________________。
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,这一现象被称为___________________。
(3)实验Ⅲ,己知: 浓H2SO4 的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体B中品红褪色,D处始终未检测到可燃性气体。A 中产生的气体是__,装置C 的作用是________________。
(4)实验Ⅲ结束后,经检验A 中既有Fe3+又有不少的Fe2+。
①若要检验Fe3+和Fe2+,下列试剂组可行的是______ (填字母)。
A.KSCN、Fe粉 B.KSCN、酸性KMnO4溶液 C.KSCN、氯水
[实验反思]
(5)①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于_____,稀硫酸的氧化性源于_______________。
②影响反应产物多样性的因素有_____________________。
【答案】 Fe+2H+=Fe2++H2↑ 钝化 SO2 去除尾气 B、C +6价S元素 +1价H元素(H+) 浓度、温度、反应物的量等
【解析】(1)实验I中,铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑;(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),形成一层致密的氧化膜,有少量气体产生,反应很快停止,这一现象被称为钝化;(3)硫酸沸点高、产生气体使品红褪色和D处始终未检测到可燃性气体可推断A中产生的气体为SO2,装置C的作用是吸收SO2防止污染环境;(4)①A、加KSCN溶液,显红色,检验铁离子,再加Fe粉,生成亚铁离子,无法检验亚铁离子,故A错误;B、加KSCN溶液,显红色,检验铁离子;再加酸性KMnO4溶液,紫红色褪去,含亚铁离子,故B正确;C、加KSCN溶液,显红色,检验铁离子;再加氯水,血红色加深,故C正确;故选BC。发生的反应为:3SCN-+Fe3+=Fe(SCN)3(血红色),5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,2Fe2++Cl2=2Fe3++2Cl-;(5)①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价S元素,稀硫酸的氧化性源于+1价H元素(H+);②影响反应产物多样性的因素有浓度、温度、反应物的量等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图为以惰性电极进行电解的装置: 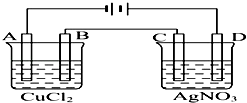
(1)写出A、B、C、D各电极上的电极反应式和总反应方程式: A: , B: , 总反应方程式:;
C: , D: , 总反应方程式: .
(2)在A、B、C、D各电极上析出生成物的物质的量之比为 .
(3)A极发生反应,B极发生反应.(填“氧化”或是“还原”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙由如下反应制得:C4H10O ![]() C4H8
C4H8 ![]() C4H8Br2(丙),丙的结构简式不可能是( )
C4H8Br2(丙),丙的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.(CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关其说法正确的是( )
Cd(OH)2+2Ni(OH)2有关其说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.放电时负极附近溶液的碱性不变
C.放电时电解质溶液中的OH﹣向正极移动
D.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( ) ① ![]() ②
② ![]() ③
③ ![]() ④C2H4 ⑤CH2=CH﹣CH=CH2⑥C2H6⑦
④C2H4 ⑤CH2=CH﹣CH=CH2⑥C2H6⑦  ⑧
⑧ 
A.④和⑧
B.①、②和③
C.⑤、⑦和⑧
D.⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景.
(1)已知H2、CO和CH3OCH3的燃烧热(△H)分别为﹣285.5kJ/mol、﹣283kJ/mol和﹣1460.0kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2 , 将悬浮物带到水面,利于除去.实验室以二甲醚燃料电池模拟该方法设计的装置如图所示: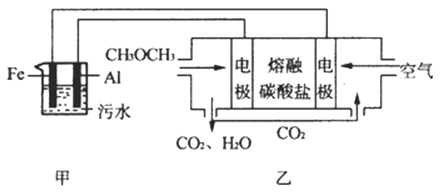
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极.写出该燃料电池的正极电极反应式 下列物质可用做电池熔融碳酸盐的是
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式:
③已知常温下Kap[Fe(OH)3]=4.0×10﹣38 , 电解一段时间后,甲装置中c(Fe3+)=
④已知:H2S的电离平衡常数:K1=9.1×10﹣8、K2=1.1×10﹣12;H2CO3的电离平衡常数:K1=4.31×10﹣7、K2=5.61×10﹣11 . 测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2﹣+H2O═CO32﹣+H2S
B.发生反应的离子方程式为:CO2+S2﹣+H2O═HCO3﹣+HS﹣
C.c(Na+)=2[c(H2S)+c(HS﹣)+c(S2﹣)]
D.c(Na+)+c(H+)=2c(CO32﹣)+2c(S2﹣)+c(OH﹣)
E.c(Na+)>c(HCO3﹣)>c(HS﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com