
 中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)
中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| 1 |
| 2 |
| 0.0576g |
| 0.3L |


科目:高中化学 来源: 题型:
| A、普通玻璃呈淡绿色是由于含Fe2+ |
| B、坩埚、蒸发皿都属于陶瓷制品 |
| C、唐“三彩”是一种玻璃制品 |
| D、高温下硅酸钙比碳酸钙稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA |
| B、常温常压下1 mol NO2气体与水反应生成NA个NO3-离子 |
| C、0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA |
| D、80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下NaR溶液的pH大于7 |
| B、加热NaR溶液时,溶液的pH变小 |
| C、稀盐酸中加入少量NaR固体,溶解后溶液的pH变大 |
| D、HR溶液中加少量NaR固体,溶解后溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
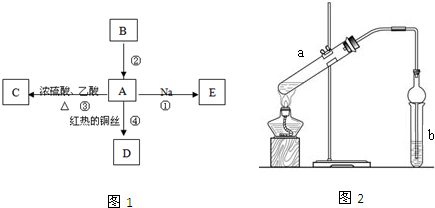
查看答案和解析>>
科目:高中化学 来源: 题型:
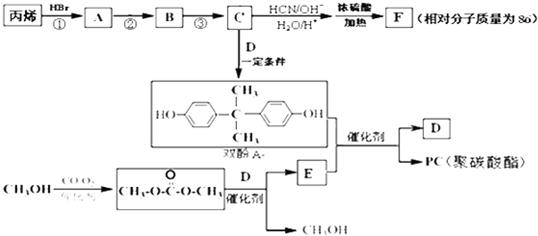

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com