
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②⑤ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl的熔点、沸点 | 比较F、Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 将SO2气体通入碳酸钠溶液中 | 比较碳、硫的非金属性强弱 |
| D | 将钠、镁、铝投入等浓度盐酸中 | 比较Na、Mg、Al的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴加酚酞。 | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞。镁带用砂纸打磨后与2mol/L盐酸反应。 | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
| | 探究同一周期从左到右元素金属性的递变规律 | 探究同一主族内从上到下元素非金属性的递变规律 | ||||||
| Ⅰ | | | | | | | | |
| Ⅱ | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若X的原子序数为m,则y的原子序数必定是m+4 |
| B.X和Y之间只能形成共价键,不能形成离子键 |
| C.X的原子半径一定小于Y的原子半径 |
| D.X和Y可属于同一周期,也可属于同一主族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
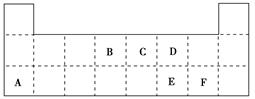
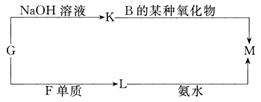
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | –1 | –2 | +4、–4 | +4、–2 | +5、–3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
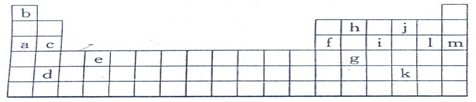
| | 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | | 9 550 | 11 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com