
| c[Fe(SCN)2+] |
| c(Fe3+)×c(SCN-) |
| 1.5×10-4 |
| 8.5×10-4c(SCN-) |
| c[Fe(SCN)2+] |
| c[Fe(SCN)2+]×c(SCN-) |
| 5×10-6 |
| 1.5×10-4×8.8×10-4 |
| V2c2-V3c3 |
| V1 |
| V2c2-V3c3 |
| V1 |


科目:高中化学 来源: 题型:
| A、①和③ | B、只有② |
| C、只有③ | D、①和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
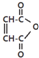 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U原子基态的外围电子排布3d104s1.
X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U原子基态的外围电子排布3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:
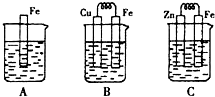
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:
 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O4是氧元素的一种同位素 |
| B、O4可能含有极性键 |
| C、同温同压下,等体积的O4气体和O2含有相同的分子数 |
| D、O4转化O2为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(O2)=3.2g?L-1?min-1 |
| B、v(O2)=0.1 mol?L-1?min-1 |
| C、v(KCl)=0.1 mol?L-1?min-1 |
| D、v(KClO3)=0.0667 mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com