
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
分析 Ⅰ.(1)用盖斯定律求反应热,根据目标方程式将已知方程式变形运算求解;
(2)根据碳酸和氢硫酸的两步电离平衡常数进行比较氢硫酸与碳酸、碳酸氢根离子离子酸性大小,从而得出反应产物,写出反应的离子方程式;
(3)利用实验1与实验2温度变化比较平衡常数来判断反应热,依据浓度商和平衡常数比较分析判断;
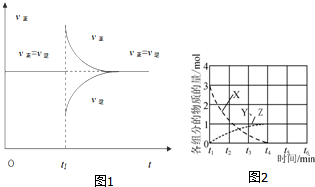
(4)根据图1t1时刻改变条件后v(正)瞬间增大,v(逆)减小,v(正)<v(逆),则平衡一定正向移动,据此分析;
Ⅱ.(5)依据一氧化氮、二氧化氮变化为氮气,甲烷变化为二氧化碳过程中电子转移守恒列式计算;
(6)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物.
解答 Ⅰ.(1)①H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
盖斯定律计算得到②×$\frac{1}{2}$-①得到焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3 kJ•mol-1,
故答案为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3 kJ•mol-1;
(2)由于Ka2=5.61×10-11<Ka1=9.1×10-8<Ka1=4.30×10-7、Ka2=5.61×10-11>Ka2=1.1×10-12,所以氢硫酸能够与碳酸钠溶液反应生成碳酸氢钠和硫氢化钠,反应的离子方程式为:CO32-+H2S=HCO3-+HS-,
故答案为:CO32-+H2S=HCO3-+HS-;
(3)则实验1升高温度实验2,验2计算平衡常数,
H2O(g)+CO(g)?CO2(g)+H2(g)
初始 0.5mol/L 1mol/L 0 0
转化 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.2×0.2}{0.3×0.8}$=0.167,温度升高K变小,温度升高平衡向逆反应方向移动,正反应为放热反应,
按10mol C0,5mol H20,2mol C02,5mol H2,分别加入该容器
Qc=$\frac{\frac{2}{2}×\frac{5}{2}}{\frac{10}{2}×\frac{5}{2}}$=0.2>K
反应逆向进行,v(正)<v(逆),
故答案为:<;<;
(4)根据图1t1时刻改变条件后v(正)瞬间增大,v(逆)减小,v(正)<v(逆),则平衡一定正向移动,故选A,
故答案为:A;
Ⅱ.(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,设尾气中NO物质的量为x,NO2物质的量为y,2NO~N2~4e-,2NO2~N2~4e-,CH4~CO2~8e-,
2x+4y=$\frac{30g}{16g/mol}$×8=15mol
x+y=$\frac{1×1{0}^{4}L×1.12%}{22.4L/mol}$=5mol
计算得到x=2.5mol,y=2.5mol
尾气中V(NO):V(NO2)=1:1
故答案为:1:1;
(6)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,
故答案为:N2O、NO2.
点评 本题综合考查化学平衡和化学反应速率等知识,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCO3(s)+O2(g)=Fe2O3(s)+2CO2(g)△H=-130 KJ/mol | |
| B. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+130 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
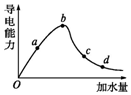 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com