


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:043
在化工生产中,要用到一种无色、易溶于水的晶体 铝铵矾,该晶体是一种复盐,其主要化学成分为十二水硫酸铝铵,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:
铝铵矾,该晶体是一种复盐,其主要化学成分为十二水硫酸铝铵,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:
NH4++AlO2-+H2O=Al(OH)3↓+NH3↑;试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式:________;若将硫酸铝铵溶液加入水稀释,物质的量浓度上升的离子是________(填离子符号)
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;
④白色沉淀完全消失;⑤白色沉淀逐渐减少.请排出以上各种现象由先到后出现的正确顺序(用序号回答)________;
(3)请写出有关反应的离子方程式:
①________
②________
③________
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出硫酸铝铵在水溶液中的电离方程式: 。?
若将硫酸铝铵溶液加入水稀释,物质的量浓度上升的离子是 (填离子符号)。?
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀?
②有刺激性气味的气体放出?
③白色沉淀量逐渐增多?
④白色沉淀完全消失
⑤白色沉淀逐渐减少
请排出以上各种现象由先到后出现的正确顺序 (用序号回答)。?
(3)请写出有关反应的离子方程式:
① 。?
② 。?
③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
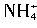 与[Al(OH)4]-在水溶液中不能大量共存,会发生如下反应:
与[Al(OH)4]-在水溶液中不能大量共存,会发生如下反应: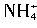 +[Al(OH)4]-=Al(OH)3↓+NH3↑+H2O。试回答:
+[Al(OH)4]-=Al(OH)3↓+NH3↑+H2O。试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
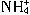 与Al
与Al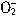 在水溶液中不能大量共存,会发生如下反应:
在水溶液中不能大量共存,会发生如下反应: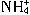 +Al
+Al +H2O=Al(OH)3↓+NH3↑。试回答:
+H2O=Al(OH)3↓+NH3↑。试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com