
| A. | Mg(OH)2 | B. | NaOH | C. | Al(OH)3 | D. | Si(OH)4 |
科目:高中化学 来源: 题型:解答题
| 实验 1 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴(1滴约为0.05mL,下同). | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液不显红色. |
| 实验 2 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴. | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液显红色. | |
| ⅲ.继续加入2mL CCl4,充分振荡、静置. | ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色. |
| 实验3 | 实验步骤 | 实验现象 |
| ⅰ.取1mL实验2中棕黄色的上层清液,再加入2mL CCl4,振荡、静置. | ⅰ.液体分层,上层呈黄色,下层呈紫红色. | |
| ⅱ.取1mL饱和碘水,加入2mL CCl4,振荡、静置. | ⅱ.液体分层,上层为无色,下层呈紫红色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
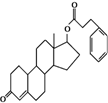
| A. | 含有四种官能团 | B. | 分子中所有碳原子不可能共平面 | ||
| C. | 是一种芳香族化合物 | D. | 含有一个酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 甲烷、乙烯和苯都能与酸性高锰酸钾溶液反应 | |
| C. | 乙酸乙酯和油脂在一定条件下都能水解 | |
| D. | 所有烷烃中都存在碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定不含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
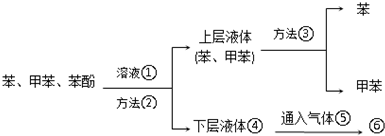
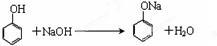 .
.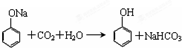 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | X溶液的体积(mL) | X溶液的浓度(mol/L) | 水的体积(mL) | |
| A | 10℃ | 20 | 3 | 10 |
| B | 20℃ | 30 | 2 | 0 |
| C | 20℃ | 10 | 4 | 20 |
| D | 10℃ | 10 | 2 | 20 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
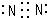 .A的最高价氧化物对应的水化物的电子式
.A的最高价氧化物对应的水化物的电子式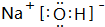 .
.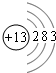 ,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com