
分析 碘化银饱和溶液中存在溶解平衡:AgI(s)?Ag+(aq)+I-(aq),由于AgI的溶解度小于AgCl,加入饱和氯化银溶液后,导致c(Ag+)增大,AgI 的沉淀溶解平衡向左移动,析出AgI沉淀后,成为AgI的饱和溶液,则:c(Ag+)>c(I-),且c(Cl-)最大,据此判断各离子浓度大小.
解答 解:碘化银饱和溶液中存在溶解平衡:AgI(s)?Ag+(aq)+I-(aq),且AgI的溶解度小于AgCl,
加入饱和氯化银溶液后,c(Ag+)增大,AgI 的沉淀溶解平衡向左移动,析出AgI沉淀后,成为AgI的饱和溶液,则:c(Ag+)>c(I-),
此时c(Cl-)最大,溶液中离子浓度大小为:c(Cl-)>c(Ag+)>c(I-),
故答案为:c(Cl-)>c(Ag+)>c(I-).
点评 本题考查了离子浓度大小比较,题目难度中等,明确难溶物溶解平衡及其影响为解答关键,试题培养了学生的分析能力、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性: Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出各步反应的化学方程式.
,写出各步反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
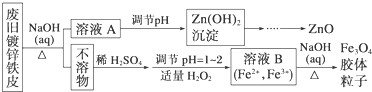
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①②的名称分别为溶解、过滤 | |
| B. | 步骤③中使用的化学仪器有酒精灯、三角架、泥三角、坩埚、玻璃棒 | |
| C. | 步骤①②③中都使用了玻璃棒,且三个操作中玻璃棒的作用不完全相同 | |
| D. | 步骤④的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com