
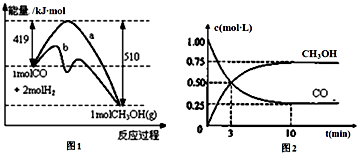
 工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol
工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol分析 (1)根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
(2)A、由图2利用转化的CO和平衡时CO的量来分析;
B、增加CO浓度,会促进氢气的转化,但本身的转化率降低;
C、该反应为反应前后压强不等的反应;
(3)根据v=$\frac{△c}{△t}$进行计算;根据三行式来计算平衡时氢气的浓度;化学平衡常数表达式等于生成物浓度幂之积比反应物浓度幂之积;增大压强平衡向气体体积缩小的方向移动;
(4)32g的CH3OH的物质的量为1mol,结合盖斯定律计算.
解答 解:(1)由图可知,反应的活化能b的较小,所以b使用的催化剂,该反应中反应物的总能量大于生成物的总能量,该反应为放热反应;
由图可知,反应物为1molCO(g)和2molH2(g),生成物为1molCH3OH(g),△H=419-510=-91 kJ•mol-1,
故反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ•mol-1,
故答案为:b;-91 kJ•mol-1;(1)b-91kJ/mol
(2)A、由图2可知生成0.75mol/LCH3OH,则反应了0.75mol/LCO,平衡时有0.25mol/LCO,即CO的起始物质的量为(0.75mol/l+0.25mol/L)×1L=1mol,故A正确;
B、增加CO浓度,会促进氢气的转化,氢气的转化率增大,但CO的转化率减小,故B正确;
C、该反应为反应前后压强不等的反应,则压强不变时,该反应达到平衡状态,故C正确;故选:ABC;
(3)v(CO)=$\frac{(1-0.25)mol/L}{10min}$=0.075 mol•L-1•min-1,
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L) 1 2 0
转化(mol/L) 0.75 1.5 0.75
平衡(mol/L) 0.25 0.5 0.75
平衡常数表达式为:K=$\frac{{C(C{H_3}OH)}}{{C(CO)•{C^2}({H_2})}}$;
容器体积压缩为0.5L,相当于增大压强,平衡正向移动,故答案为:0.075mol/(L•min);0.5mo/L;K=$\frac{{C(C{H_3}OH)}}{{C(CO)•{C^2}({H_2})}}$;正向;
(4)已知①CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g);△H=-193kJ/mol,②H2O(l)=H2O(g)△=44KJ/mol,
利用盖斯定律将①-②×2可得CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)
△H=(-193kJ/mol)-44KJ/mol×2=-281kJ/mol,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-281kJ/mol.
点评 本题考查反应速率计算、化学平衡的影响因素、平衡常数的计算热化学方程式的书写等,难度中等.应注意图象中的信息是解答本题的关键.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
| 投料Ⅱ | 0.5mol/L | 1.5mol/L | 1.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
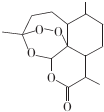
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可使酸性高锰酸钾溶液褪色 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
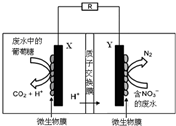
| A. | 电池工作时,既能净化废水,又能发电 | |
| B. | X电极为负极,工作时发生氧化反应 | |
| C. | 正极反应式为2NO3-+10e-+6H2O═N2↑+12OH- | |
| D. | 该电池在常温和高温时都可以工作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| C. | 盐:胆矾、小苏打、铜绿 | |
| D. | 无丁达尔现象的分散系:碘的四氯化碳溶液、淀粉溶液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com