
| A. | 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
分析 A.漏写生成氢氧化铜的离子反应;
B.电子、电荷不守恒;
C.电子、电荷不守恒;
D.反应生成醋酸钙、水、二氧化碳.
解答 解:A.在硫酸铜溶液中加入过量氢氧化钡溶液的离子反应为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故A错误;
B.钠与水的反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.氯气通入氢氧化钠溶液中的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故C错误;
D.大理石溶于醋酸的反应的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子反应的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3 mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
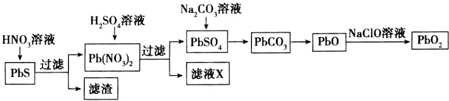
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
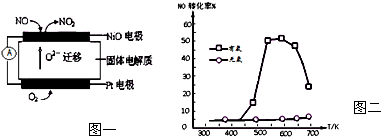
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(4) | B. | (2)(3)(4)(1) | C. | (4)(1)(3)(2) | D. | (3)(4)(1)(2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com