
 .
.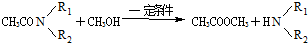
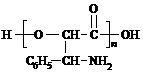 或
或 ;
;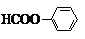 或
或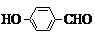 .
.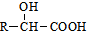 ②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl
②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl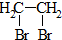
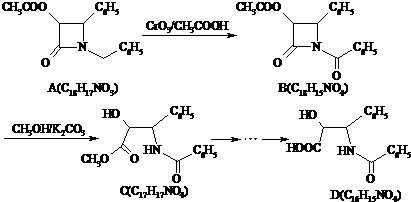
分析 (1)根据原子守恒,及A与CH3COOCH2COCl的结构,确定X的结构简式.
(2)根据酯和酰胺的结构以及生成的酯的结构分析解答;
由酰胺在过量醇中能发生醇解反应的信息可知,在如图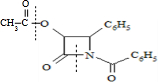 所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子;
所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子;
(3)最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F,由D的结构可知,E为HOOC-CH(OH)-CH(NH2)-C6H5,F为C6H5-COOH,
①E分子中含有-COOH、-OH、-NH2,可以通过形成酯缩聚生成高聚物,也可以通过成肽键发生缩聚反应生成高聚物;
②C6H5-COOH的同分异构体中,属于芳香族化合物、能发生银镜反应,故含有苯环、醛基或是甲酸酚酯,核磁共振氢谱有4个峰,含有4种不同的H原子,据此书写;
(4)CH3COOCH2COCl中含有酯基,结合信息可知,先由CH3CHO氧化生成CH3COOH,HCHO在HCN、酸性条件下合成HOCH2COOH,HOCH2COOH在PCl3条件下合成HOCH2COCl,再由CH3COOH与HOCH2COCl在浓硫酸、加热条件下发生酯化反应生成CH3COOCH2COCl.
解答 解:(1)CH3COOCH2COCl+X→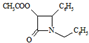 +HCl,X分子中含碳氮双键(C=N),应在如图
+HCl,X分子中含碳氮双键(C=N),应在如图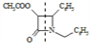 虚线所示位置是反应成键位置,故X为
虚线所示位置是反应成键位置,故X为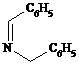
故答案为: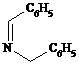
(2)由反应方程式CH3COOC2H5+CH3OH$\stackrel{一定条件下}{→}$CH3COOCH3+C2H5OH,可知-OCH3取代-OC2H5,
CH3CO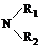
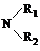
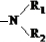 ,故酯和酰胺在过量醇中能发生醇解反应属于取代反应,由酰胺在过量醇中能发生醇解反应的信息可知,在如图
,故酯和酰胺在过量醇中能发生醇解反应属于取代反应,由酰胺在过量醇中能发生醇解反应的信息可知,在如图 所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子,故还生成CH3COOCH3,
所示虚线发生化学键断裂,O原子、N原子连接甲醇中羟基中的H原子,-OCH3连接断键处的C原子,故还生成CH3COOCH3,
故答案为:取代反应;CH3COOCH3;
(3)最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F,由D的结构可知,E为HOOC-CH(OH)-CH(NH2)-C6H5,F为C6H5-COOH,
①E分子中含有-COOH、-OH、-NH2,可以通过形成酯缩聚生成高聚物,也可以通过成肽键发生缩聚反应生成高聚物,故可能的高聚物为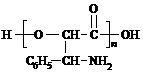

故答案为: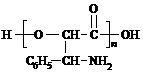

②C6H5-COOH的同分异构体中,属于芳香族化合物、能发生银镜反应,故含有苯环、醛基或是甲酸酚酯,核磁共振氢谱有4个峰,含有4种不同的H原子,符合条件的结构为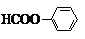
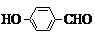
故答案为: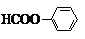
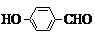
(4)CH3COOCH2COCl中含有酯基,结合信息可知,先由CH3CHO氧化生成CH3COOH,HCHO在HCN、酸性条件下合成HOCH2COOH
,HOCH2COOH在PCl3条件下合成HOCH2COCl,再由CH3COOH与HOCH2COCl在浓硫酸、加热条件下发生酯化反应生成CH3COOCH2COCl,故合成路线流程: ,
,
故答案为: .
.
点评 本题考查有机物合成,为高频考点,根据反应前后有机物结构简式变化确定反应类型,难点是有机合成路线设计,要根据反应物、产物及其结构特点结合题给信息设计,注意基础知识的灵活运用,侧重考查学生综合知识运用能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH的电子式为Na+[:H]- | |
| B. | NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液一定呈酸性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(OH-)═c(H+)的溶液一定呈中性 | |
| D. | 水中加入硫酸恢复至室温后,Kw=c(H+)•c(OH-)将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液具有相同的性质:均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 只有胶状的物质如胶水、果冻类的才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
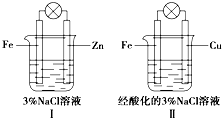
| A. | Ⅰ和Ⅱ中正极均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| D. | Ⅰ和Ⅱ中灯泡均会发亮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 方案 | X | Y | a溶液 |
| A | 铜 | 石墨 | CuSO4 |
| B | 铜 | 铁 | CuSO4 |
| C | 铁 | 铜 | Fe(NO3)3 |
| D | 铁 | 铜 | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
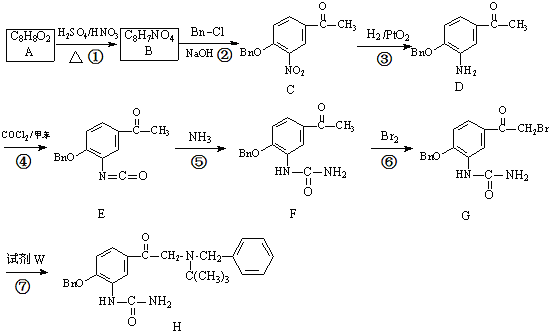
 试剂W
试剂W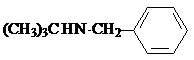 .
.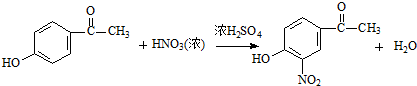 .
.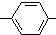 CH2
CH2 N=C=O生成高聚物的结构简式
N=C=O生成高聚物的结构简式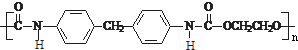 .
.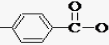 -CH2CH2N(C2H5)2(无机试剂任用)
-CH2CH2N(C2H5)2(无机试剂任用) 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
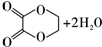 ,B的结构简式为OGC-CHO.
,B的结构简式为OGC-CHO.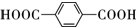
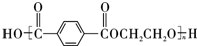 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com