
【题目】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25℃时,浓度均为0.10 mol/L 的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。(已知:Ka(CH3COOH)=1.75×10–5,Kb为CH3COONa的水解常数),下列说法正确的是
A.混合溶液加水稀释,c(OH–)减小
B.25℃时,Ka(CH3COOH)<Kb(CH3COO–)
C.c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D.向1.0 L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液pH基本不变
【答案】D
【解析】
A.该混合溶液pH<7,溶液显酸性,加水稀释,溶液中c(H+)减小,由于Kw= c(H+)·c(OH–),在温度不变时,Kw不变,溶液中c(H+)减小,则c(OH–)增大,A错误;
B.浓度均为0.10 mol/L 的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,说明酸的电离作用大于盐的水解作用,所以Ka(CH3COOH)>Kb(CH3COO–),B错误;
C.根据物料守恒可得①:2c(Na+)=c(CH3COO-)+c(CH3COOH),根据电荷守恒可得②: c(CH3COO-)+c(OH-)=c(Na+)+c(H+),将①+2×②,整理可得c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),溶液pH=4.76,则c(H+)>c(OH–),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),C错误;
D.向该缓冲溶液中加入几滴NaOH溶液,由于缓冲溶液中存在平衡:CH3COOH![]() CH3COO-+H+,NaOH电离产生的OH-中和溶液中H+,使电离平衡正向移动,因此反应后溶液pH基本不变,D正确;
CH3COO-+H+,NaOH电离产生的OH-中和溶液中H+,使电离平衡正向移动,因此反应后溶液pH基本不变,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整可获得清洁能源,在催化剂作用下发生如下两步反应∶
反应①∶CH3OH(g)==CO(g)+2H2(g) △H1
反应②∶CO(g) + H2O(g)==CO2(g)+H2(g) △H2
根据能量变化示意图,下列说法不正确的是( )
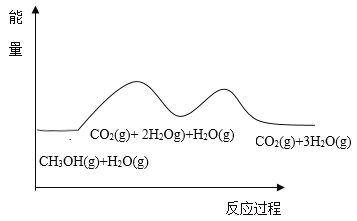
A.总反应的热化学方程式为∶ CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ![]()
B.1mol CO(g)和1mol H2O(g)的总键能大于lmol CO2(g)和1mol H2(g)的总键能
C.甲醇与水蒸气催化重整的总反应速率取决于反应①
D.催化剂在反应中改变了活化能,加快了反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应2C(s)+O2(g)![]() 2CO(g)、2CO(g)+O2(g)
2CO(g)、2CO(g)+O2(g)![]() 2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )
2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )
A.12g C所具有的能量一定高于28g CO所具有的能量
B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在装有MnO2的试管中加入H2O2可以快速制取O2,回答下列问题:
(1)H2O2中O的化合价是_____,写出H2O2中含有的化学键类型____(填字母序号)。
A.极性共价键 B.非极性共价键 C.离子键
(2)写出该反应的化学方程式 _______。
(3)MnO2的作用是______。
(4)下列措施可以加快该化学反应速率的是_______。
A.滴加FeCl3溶液 B.加热 C.降低压强 D.增大H2O2的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图,下列说法不正确的是

A.反应温度如果过高,制得HNO3可能会呈现黄色
B.反应方程式为:NaNO3 + H2SO4(浓)![]() NaHSO4 + HNO3↑
NaHSO4 + HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈甑不适宜制备沸点过低的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。
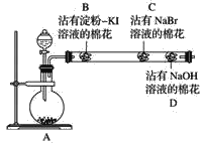
(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如图所示:
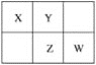
其中Z元素的原子序数是其最外层电子数的3倍。下列叙述中正确的是( )
A.元素Z位于第三周期ⅣA族
B.元素Y的原子序数为15
C.元素X最外层有6个电子
D.元素W最高价氧化物为WO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,在100mL0.1mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化和H2S的挥发)。下列说法正确的是( )
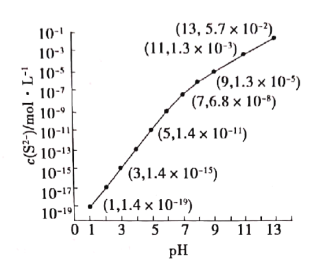
A.当c(H2S)+c(HS-)=0.043mol·L-1时,pH=13
B.pH=1时,c(H+)=c(Cl-)+c(HS-)+ c(S2-)+c(OH-)
C.向该溶液中加入NaOH固体至中性时c(Na+)>c(HS-)>c(S2-)>c(H+)=c(OH-)
D.已知:Ksp(MnS)=2.8×10-13,某溶液含amol·L-1Mn2+、0.10mol·L-1H2S,当溶液pH=5时,Mn2+开始沉淀,则a=0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1 molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.SO2与O2的转化率可能相等
B.容器中一定存在n(SO2)>1mol且n(SO3)<2mol
C.放出的热量为197kJ
D.当O2的转化率为50%时SO2和SO3 的物质的量一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com