
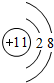 ,故答案为:
,故答案为: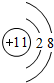 ;
;

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、8g甲烷含有的共价键数约为NA |
| B、常温常压下,22.4L二氧化碳原子总数为3NA |
| C、2.8g铁粉与足量稀硝酸反应,转移0.15NA个电子 |
D、 3.2g硫(结构见图)含S-S键的数目为0.8NA 3.2g硫(结构见图)含S-S键的数目为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.
将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.查看答案和解析>>
科目:高中化学 来源: 题型:
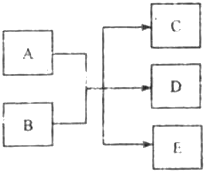 在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B、某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |
| C、离子化合物中不可能存在共价键 |
| D、原子序数为12的元素位于元素周期表的第三周期ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下,
| ||
| B、加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- | ||
| C、加入苯酚显紫色的溶液:NH4+、K+、Cl-、S2- | ||
| D、由水电离产生的c(H+)=1×10-12的溶液:NH4+、Na+、AlO2-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com