
| A. | 只有②④⑤ | B. | 只有⑤⑦ | C. | 只有①③⑦ | D. | 只有①② |
分析 ①浓硫酸具有吸水性、浓盐酸具有挥发性;
②二氧化硫能和有色物质反应生成无色物质,次氯酸具有强氧化性漂白;
③二氧化硫能和有色物质反应生成无色物质,二氧化硫能被强氧化剂溴氧化;
④氨气能和浓硫酸反应生成盐,碘化氢气体被浓硫酸氧化;
⑤浓硫酸具有强氧化性,常温下浓硫酸与铁发生钝化,加热条件下浓硫酸能与木炭发生氧化还原反应;
⑥浓硫酸能将有机物中的H、O元素以2:1水的形式脱去,氢氟酸能和二氧化硅反应生成四氟化硅;
⑦二氧化碳、二氧化硫都与澄清石灰水发生反应生成难溶性钙盐.
解答 解:①浓硫酸具有吸水性、浓盐酸具有挥发性,浓硫酸和浓盐酸在空气中敞口放置时浓度均减小,但原理不同,故错误;
②二氧化硫具有漂白性、次氯酸具有强氧化性,二者都能使品红溶液褪色,但漂白原理不同,故错误;
③二氧化硫具有漂白性和还原性,二氧化硫使品红溶液褪色体现漂白性、使溴水褪色体现还原性,故错误;
④氨气能和浓硫酸反应生成盐,碘化氢气体能被浓硫酸氧化,所以前者浓硫酸体现酸性、后者浓硫酸体现氧化性,故错误;
⑤浓硫酸具有强氧化性,能和C、Fe发生氧化还原反应,所以能用同一原理解释,故正确;
⑥前者浓硫酸体现脱水性、后者氢氟酸体现酸性,所以反应原理不同,故错误;
⑦二氧化碳、二氧化硫都能和澄清石灰水反应生成难溶性钙盐而使澄清石灰水变浑浊,故正确;
故选B.
点评 本题考查了物质间的反应,明确物质性质是解本题关键,注意二氧化硫、次氯酸、过氧化钠等物质漂白原理的差别,注意不能用澄清石灰水鉴别二氧化碳和二氧化硫,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | B. | H2SO4溶液消耗的NaOH多 | ||
| C. | HCl溶液消耗的NaOH多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强 A转化率 温度 | P1(MPa) | P2(MPa) |
| 400℃ | 96 | 99 |
| 500℃ | 96 | 97 |
| A. | 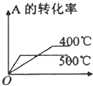 | B. | 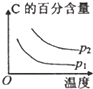 | C. | 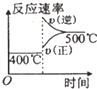 | D. | 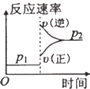 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.80 mol | B. | 0.72 mol | C. | 0.45 mol | D. | 0.40 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
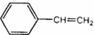 ,它不可能具有的性质是( )
,它不可能具有的性质是( )| A. | 既能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| B. | 易溶于水和有机溶剂 | |
| C. | 能与H2在一定条件下发生反应 | |
| D. | 能发生加聚反应,生成物可用 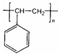 表示 表示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com