
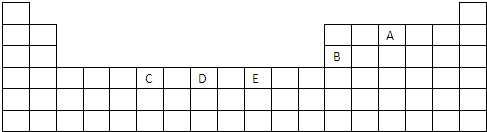
| Na | Mg | Si | |
| I1/kJ?mol-1 | 496 | 738 | 787 |


科目:高中化学 来源: 题型:
| ①H2SO4溶液中H2SO4 | ①H2SO4溶液中HSO4- | ②NaHSO4溶液中HSO4- | ③CH3COOH 溶液 |
④HCl溶液 |
| 100% | 10% | 29% | 1.3% | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| B、AgCl悬浊液中滴加KI,出现黄色沉淀:AgCl+I-?AgI+Cl- |
| C、在银氨溶液中滴加过量稀硝酸:[Ag(NH3)2]++2H+═Ag++2NH4+ |
D、水杨酸(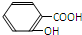 )与过量的Na2CO3溶液混合: )与过量的Na2CO3溶液混合: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=12的溶液中:K+、Na+、Br-、AlO2- |
| B、无色溶液中:H+、K+、MnO4-、C2O42- |
| C、c(Fe3+)=0.1mol?L-1的溶液中:K+、H+、SCN-、I- |
| D、由水电离出的c(OH-)=1.0×10-13mol?L-1的溶液中:Na+、NH4+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)?c(CO) |
| c(H2O) |
| T/K | 300 | 400 | 500 | … |
| K/(mol2?L-2) | 6×106 | 2×107 | K1 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ca2+、Cl-、HCO3- |
| B、K+、Na+、NO3-、MnO4- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、NH4+、Al3+、NO3-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com