
| 92 |
| 3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCHO |
| B��CH3COOH |
| C��CH3CH2OH |
| D��CH3COOC2H5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������Ƭ��X��A������������Ҫ���ã�Ϊ�о�X�Ľṹ����������A��һ��������ˮ��ֻ�õ�B��
��������Ƭ��X��A������������Ҫ���ã�Ϊ�о�X�Ľṹ����������A��һ��������ˮ��ֻ�õ�B��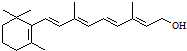 ����C�����ⶨȷ��C�ķ���ʽΪC7H6O3��C��FeCl3ˮ��Һ����ɫ����NaHCO3��Һ��Ӧ��CO2����
����C�����ⶨȷ��C�ķ���ʽΪC7H6O3��C��FeCl3ˮ��Һ����ɫ����NaHCO3��Һ��Ӧ��CO2����
| ��ԭ |
| ��NaCN |
| ��H3O+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� ѡ�� | �� | �� | �� |
| A | AlCl3 | NH3?H2O | NaAlO2 |
| B | NaOH | ��NH4��2SO3 | H2SO4 |
| C | SiO2 | NaOH | HF |
| D | CO2 | Ca��OH��2 | Na2CO3 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��AlCl3 |
| B��NaHCO3 |
| C��Mg |
| D��NH4Cl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��AgNO3 |
| B��H2O |
| C��NaCl |
| D��Na2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ��ͬʱ�������ֽ������� |
| B��һ������������ͭ |
| C��һ����������þ |
| D������ͬʱ��������þ����������һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1�� | ����ʻ�ɫ��֤��ԭ��Һ�д���Na+�� |
| ����2�� | |
| ����3����ȡ����ԭ��Һ���Թ��У� | Ʒ����Һ��ɫ��֤��ԭ��Һ�д���SO32-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������ӵ�Ħ��������96 g |
| B��CO2��Ħ��������44 g/mol |
| C��1 mol H2O��������18 g/mol |
| D��HCl����Է���������36.5 g/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com