
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。
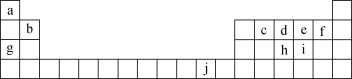
回答下列问题:
(1)写出元素f的基态原子核外电子排布式:____。
(2)写出元素h的基态原子核外电子轨道表示式:________。
(3)基态b原子电子占据最高能级的电子云轮廓图为_________
(4)ce2分子的电子式为____。
(5)d、g、h的原子半径由小到大的顺序是_______(用元素符号表示)
(6)用一个化学方程式证明e、i的非金属性的强弱_________。
(7)d的简单氢化物比h的简单氢化物沸点____(填“高”或“低”),请分析其原因____,写出j的原子结构示意图_____________
【答案】1s22s22p5 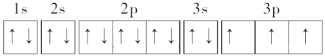 球形 CO2 N<P<Na 2H2S+O2
球形 CO2 N<P<Na 2H2S+O2![]() 2H2O+S 高 NH3分子间可以形成氢键,而PH3分子间不能形成氢键
2H2O+S 高 NH3分子间可以形成氢键,而PH3分子间不能形成氢键 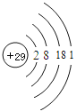
【解析】
根据元素在周期表中的位置可知,a为H、b为Be、c为C、d为N、e为O、f为F、g为Na、h为P、i为S、j为Cu。根据元素的原子序数,写出其核外电子排布式、以及原子示意图,根据元素在周期表中的变化规律,进行原子半径大小比较,以及非金属性强弱的判断。
(1)元素f为F元素,F元素的原子序数为9,其基态原子核外电子排布式1s22s22p5;
(2)元素h为P元素,P元素的原子序数为15,其基态原子核外电子排布式为1s22s22p63s23p3,故基态P原子核外电子轨道表示式为 ;
;
(3)元素b为Be元素,其原子序数为4,核外电子排布式为1s22s2,故基态Be原子电子占据最高能级2s能级,2s能级的电子云轮廓图为球形;
(4)元素c为C元素、元素e为O元素,故ce2分子的电子式为CO2;
(5)元素d为N元素、元素g为Na元素、元素h为P元素,同周期主族元素的原子半径随着原子序数的增加,半径逐渐减小,同主族元素的原子半径随着原子序数的增加,电子层数增多,原子半径增加,故N、Na、P的原子半径由小到大的顺序是N<P<Na;
(6)元素e为O元素、元素i为S元素,H2S与O2反应生成S单质,这个反应能证明S的非金属性比O的非金属性强,反应方程式为2H2S+O2![]() 2H2O+S;
2H2O+S;
(7)d的简单氢化物的为NH3,h的简单氢化物PH3,NH3分子间可以形成氢键,而PH3分子间不能形成氢键,所以NH3的沸点比PH3的沸点高;元素j为Cu元素,Cu元素的原子序数为29,其原子结构示意图为 ;
;


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:C (s) +H2O(g)![]() CO(g) +H2(g) △H=+131.3kJmol-1
CO(g) +H2(g) △H=+131.3kJmol-1
(1)该反应的化学平衡常数表达式K=___,若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),H2O(g)的平衡转化率为___
(2)对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快化学反应速率的措施是____。
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
(3)上述反应达到平衡后,移走体系中部分C(s),平衡_____,将产生的CO全部移走,平衡___(以上两空选填“向左移”、“向右移”、“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.1mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.1mol·L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
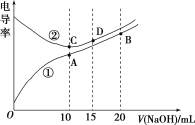
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C.在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
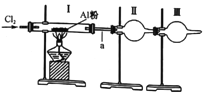
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A. 二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
B. lmol环戊二烯(![]() )中含有
)中含有![]() 键的数目为11NA
键的数目为11NA
C. 二茂铁分子中存在π键
D. Fe2+的电子排布式为ls 22s 22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)________。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)___,反应的化学方程式为________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母) _______。
A 酸性 B 吸水性 C 脱水性 D 强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,探究SO2与品红作用的可逆性,请写出实验操作及现象______。;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______。
(5)工厂煤燃烧产生的烟气若直接排放到空气中,引发的主要环境问题有_____。
A 温室效应 B 酸雨 C 粉尘污染 D 水体富营养化
工业上为实现燃煤脱硫,常通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,与烟气中SO2反应从而将硫固定,其产物可作建筑材料。写出其中将硫固定的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)为白色结晶粉末,易溶于水,在中性或碱性条件下稳定,在酸性条件下发生反应(S2O32-+2H+=S↓+SO2+H2O),是一种重要的化工原料。请回答下列问题:
(1)Na2S2O3溶液可用作照相底片(AgBr)中的定影剂,其原理是将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。写出该络合反应的离子方程式___。
(2)工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。巳知该反应中C(碳)原子化合价不变,则氧化剂和还原剂物质的量之比为___。
(3)Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,设计实验方案检验Na2S2O3是否变质(已知BaS2O3微溶于水)___。
(4)现有含Na2S2O3·5H2O的样品,用以下方法计算Na2S2O3·5H2O的质量分数。
a.取样品7.0g溶于蒸馏水中,并定容至500mL容量瓶中待用。
b.取0.01mol.L-1的K2Cr2O7标准溶液20.00mL于锥形瓶中,加过量KI溶液并酸化,加2滴淀粉指示剂,用a中未知浓度的Na2S2O3待测液滴定至终点,共用去25.00mL。(已知2S2O32-+I2=S4O62-+2I-),在酸性环境中Cr2O72-被还原为绿色的Cr3+)。
回容下列问题:
①滴定终点的现象是___。
②样品中Na2S2O3·5H2O的质量分数为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:16g液态肼与液态过氧化氢恰好完全反应生成氮气和液态水时放出321kJ热量,试写出液态N2H4和液态H2O2反应的热化学方程式__________。
(2)已知:N2H4(l)+O2(g)=N2(g)+2H2O(g)。肼(N2H4)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是_______。
(3)将浓度均为0.10 mol·L-1的CH3COOH溶液和NaOH溶液等体积混合,所得混合溶液中各种离子浓度大小顺序_______________。
(4)已知某温度下,纯水中的c(H+)= 2.0×10-7 mol/L。该温度下,测定某硫酸溶液中c(SO42-)=5×10-6mol/L,该硫酸溶液中由水电离出的OH-浓度为_________________。
(5)在25 ℃时,向V mL pH=m的HNO3中滴加pH=n的KOH溶液10V mL时,溶液中n(NO3-)=10 n(K+),则m+n的值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补齐下列物质间的反应与对应反应类型的连线。
A. 从乙烯得到聚乙烯的反应 | a. 氧化反应 |
B. 乙醇与酸性重铬酸钾溶液反应 | b. 加聚反应 |
C. 乙烯与溴的四氯化碳溶液反应 | c. 取代反应 |
D. 乙酸和乙醇在浓硫酸作用下的反应 | d. 加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com