
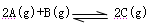 ;△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变)
;△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变) 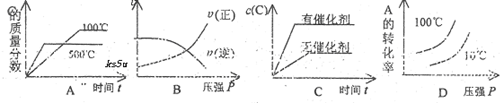


科目:高中化学 来源:不详 题型:单选题
 N2(g)+2CO2(g) 。下列说法错误的是
N2(g)+2CO2(g) 。下列说法错误的是| A.升高温度可使该反应的正逆反应速率同时增大 |
| B.单位时间内消耗CO和NO的物质的量相等时,反应达到平衡 |
| C.反应达到平衡后,NO的反应速率保持恒定 |
| D.使用高效催化剂可增大反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
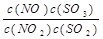 。恒容时,温度升高,NO浓度减小。下列说法正确的是
。恒容时,温度升高,NO浓度减小。下列说法正确的是 | A.该反应的焓变为正值 |
| B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为:NO+SO3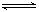 NO2+SO2 NO2+SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ΔH<0,ΔS>0的反应肯定是自发的 | B.ΔH<0,ΔS<0的反应肯定是自发的 |
| C.ΔH>0,ΔS>0的反应肯定是自发的 | D.ΔH>0,ΔS<0的反应肯定是自发的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2(g) + 2O2(g) = 2NO2(g) △H =" +" 67.7 kJ/mol |
| B.CaCO3(s) =CaO(s) +CO2(g) △H =" +" 1921.8 kJ/mol |
| C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l )△H =" -2804" kJ/mol |
| D.2CO(g)+O2 (g)=2CO2(g)△H= -566 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CCl4(g)+2H2O(g)=CO2(g)+4HCl(g) |
| B.CaO(s)+CO2(g)=CaCO3(s) |
| C.Cu2+(aq)+Zn(s)=Cu(s)+Zn2+(aq) |
| D.Na(s)+H+(aq)+H2O(l)=Na+(aq)+H2(g)+OH-(aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放热反应均是自发反应 |
| B.ΔS 为正值的反应均是自发反应 |
| C.物质的量增加的反应,ΔS一定为正值 |
D.铁在潮湿空气中生锈是自发过 程 程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com