
| A. | 在卤代烃中,卤素原子与碳原子间形成共价键 | |
| B. | 在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 | |
| C. | 聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 | |
| D. | 卤代烃的沸点比相应烷烃的沸点低 |
分析 A.非金属卤素原子与碳原子能形成共价键;
B.溴乙烷(CH3CH2Br)为非电解质,不能电离;
C.聚四氟乙烯含有C、H以及卤素原子;
D.相对分子质量越大,沸点越高.
解答 解:A.在卤代烃中,非金属卤素原子与碳原子形成共价键,故A正确;
B.在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴原子,溴乙烷为非电解质,不能电离,故B错误;
C.聚四氟乙烯(塑料王)为高分子化合物,但也属于卤代烃,故C错误;
D.卤代烃比相应的烷烃的相对分子质量越大,沸点越高,故D错误;
故选A.
点评 本题主要考查有机物的结构和性质,为高频考点,题目涉及卤代烃的结构与性质,侧重物质物理性质的考查,题目难度不大,注意卤代烃、相应的烷烃沸点高低的规律.


科目:高中化学 来源: 题型:推断题
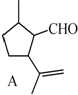 $→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$
$→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$ $→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$
$→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$ 二氢荆芥内酯
二氢荆芥内酯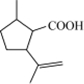 .
.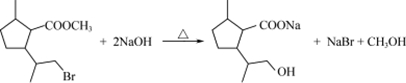 .
. .
.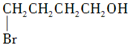 制备
制备 的合成路线图(无机试剂任选).合成路
的合成路线图(无机试剂任选).合成路查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;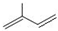 ;
;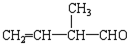 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:1molC、1molCO分别按下式反应(燃烧):
已知:1molC、1molCO分别按下式反应(燃烧):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
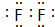 .
.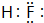 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com