
| A. | 石灰石在高温下的分解反应 | B. | 金属钠和水的反应 | ||
| C. | 盐酸与氢氧化钠溶液的反应 | D. | 铝热反应 |
科目:高中化学 来源: 题型:解答题
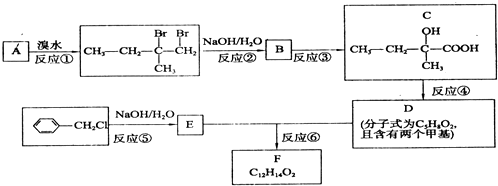
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
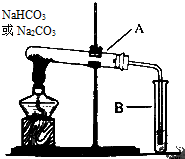 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com