
取1.43 g Na2CO3·xH2O溶于水配成10 mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0 mL,并收集到112 m L CO2(标准状况)。试计算:
L CO2(标准状况)。试计算:
⑴ CO2的物质的量
⑵ Na2CO3·xH2O的物质的量。
⑶ x的值。
⑷所用稀盐酸的物质的浓度。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
在一个固定体积的密闭容器中,加入4mol A和2mol B发生反应:2A(g)+B(g) 3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A.8mol A+4mol B B.2mol A+1mol B
C.6mol C+2mol D+2mol B D.6mol C+2mol D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
已知:
①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ/mol
②2CH3OH(g)=C2H4(g)+2H2O(g)△H2=﹣29.1kJ/mol
③C2H5OH(g)=CH3OCH3(g)△H3=+50.7kJ/mol
则C2H4(g)+H 2O(g)=C2H5OH(g)的△H为( )
2O(g)=C2H5OH(g)的△H为( )
A.﹣45.5kJ/mol B.+45.5kJ/mol C.﹣55.9kJ/mol D.+55.9kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
可逆反应A(g)+3B(g) 2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
A.v(A)=0.5 mol/(L•min) B.v(B)=0.02mol/(L•s)
C. v(C)=0.8 mol/(L•min) D.v(D)=0.01mol/(L•s)
v(C)=0.8 mol/(L•min) D.v(D)=0.01mol/(L•s)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:填空题
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、Mg2+、Cl-、SO42-
B.滴加石蕊试液显红色的溶液::K+、Al3+、Cl-、NO3-
C.含有0.1mol·L-1Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
2SO2+O2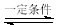 2SO3 是工业上制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3 是工业上制造硫酸的重要反应。下列关于该反应的说法正确的是
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率 
D.一定条件下达到反应限度时SO2全部转化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com