
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为 ;用电子式表示乙与戊形成化合物的过程 。
(2)丙、丁、戊的离子半径由大到小的顺序为 ;乙、戊、己的氢化物的还原性最弱的是 。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式 ;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为 。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为 。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为: 。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式: 。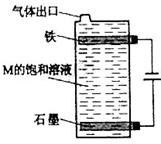
(1) 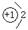 (1分)
(1分) 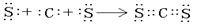 (2分)
(2分)
(2)S2->Na+>Al3+ (2分) HCl(2分)
(3)H-C≡C-H (1分) C2H2 + 4H2O ? 10e-= 2CO2+10H+(2分)
(4)Al(OH)3+OH- =AlO2- +2H2O (2分); NaHS+HCl= NaCl+H2S 或 Na2S + H 2S =2 NaHS(2分)
(5)NaCl+H2O NaClO+H2↑ (2分)
NaClO+H2↑ (2分)
解析试题分析:根据丙、丁、戊处于同一周期,且丙、丁、戊的最高价氧化物的水化物之间都能发生反应,可知丁为Al,该三种元素处于第三周期,氢氧化铝能够与强碱和强酸反应,结合题意,原子序数依次增大的短周期主族元素,推出丙为Na,戊为S,己为Cl;根据乙元素最高化合价与最低价的代数和为0,乙为C元素,甲、丙处于同一主族,甲为H元素。(1)氢的阴离子最外层有2个电子,碳和硫之间以共价键形成CS2;(2)根据电子层数越多半径越大,电子层排布相同的离子,离子半径大小与核电荷数大小成反比,即S2->Na+>Al3+ ,氢化物的还原性与非金属性成反比例,非金属性越强,其氢化物的还原性越弱,其还原性顺序:H2S>CH4>HCl;(3)甲、乙两元素形成的化合物属于烃类,含有极性键又含有非极性键,且相对分子质量最小的物质,含2个碳,含H个数最少,综合判断为乙炔,结构简式为:H-C≡C-H ,乙炔燃料电池,负极是乙炔失去电子发生氧化反应,酸性条件下电极反应式为: C2H2 + 4H2O ? 10e-= 2CO2+10H+;(4)氢氧化钠与氢氧化铝反应离子方程式为Al(OH)3+OH- =AlO2- +2H2O ,H、Na、S、Cl形成的化合物,应该是硫化物(H2S、NaHS或Na2S)和氯化物(HCl和NaCl),其中能发生反应的是NaHS+HCl= NaCl+H2S或Na2S + H 2S =2 NaHS;(5)电解饱和氯化钠溶液,阳极在装置的下部,阳极反应生成的氯气往上溢出的过程中与阴极附近的氢氧化钠反应生成次氯酸钠,起到消毒作用,总电解反应为NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
考点:元素周期律、离子方程式书写、电解池反应原理知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第三周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是________(填序号)。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g) H2(g)+
H2(g)+ S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:____________________________________。
②电化学法
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是______________________________;
反应池中发生反应的化学方程式为____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)D的原子结构示意图为 ________ ,丙的电子式为___________ ,E在周期表中的位置为 。
(2)下列说法正确的有 。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 __________________ 。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式 ____________________________ 。
(5)甲溶液显 (填“酸性”、“碱性”或“中性”),原因是 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
)已知甲、乙、丙、丁、戊、己为短周期元素形成的六种粒子,它们的电子总数都为18,请回答下列问题:
(1)甲为双核单质分子,可与水发生置换反应,甲的电子式为 。
(2)乙为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,该反应的离子方程式为 。
(3)丙为含两种元素的分子,且原子个数比为1∶1,实验室中可以用丙制备氧气,反应的化学方程式为 。
(4)戊属于烃,已知1 g戊在氧气中完全燃烧放出52 kJ的热量,戊燃烧的热化学方程式为 。
(5)己为两种元素组成的六原子分子,常用作火箭的燃料,则己的化学式为 ______________ ,分子中含有的化学键为 (填“离子键”或“共价键”)。己与丙反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大。A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续)。
(1)A在元素周期表中的位置是 。
(2)B2的电子式为 ,C、D、F对应的简单离子半径由小到大的顺序为 (用离子符号表示)。
(3)C、F的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
(4)化合物Y由C、E两元素组成,将Y、B单质与A单质按1∶1∶3在一定条件下反应可得到Z和AC,Z的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,W是最常见的黑色金属之一。
(1)Z位于元素周期表中的位置是 ,W3+的最外层电子排布式是______,X的氧化物XO2与H2O比较,熔点较高的是______ (填化学式)。
(2)加热条件下,Z的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成Z的最髙价含氧酸,写出此反应的化学方程式 。.
(3)比较Y、W性质的活泼性 (用一个化学反应方程式表示)。
(4)2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5。汽车尾气净化的主要原理为:2NO(g)+2CO(g) 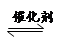 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。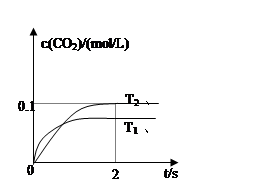
据此判断:
该反应为 反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)= ;
(5)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,
在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(6)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)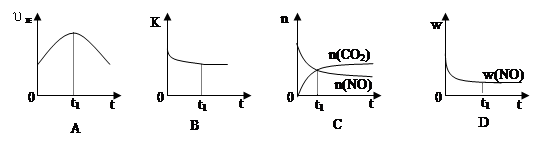
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的电子排布图是 ;D元素原子的价电子排布式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题: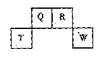
(1)T的原子结构示意图为
(2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的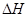 = ( 注:题中所涉单质均为最稳定单质)。
= ( 注:题中所涉单质均为最稳定单质)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com