
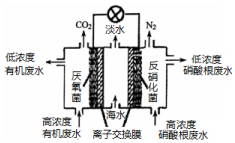
| A. | 该电池能在高温下工作 | |
| B. | 该电池工作时,中间室中的Cl-移向右室 | |
| C. | 正极上发生的电极反应:2NO3-+6H2O+10e-═N2↑+12OH- | |
| D. | 若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6转移4 mol电子 |
分析 该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+6H2O+10e-═N2↑+12OH-,左边装置电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,阴离子移向负极,据此分析解答.
解答 解:A、高温下能使厌氧菌和反硝化菌等蛋白质变性,所以不能在高温下工作,故A错误;
B、阴离子移向负极,所以该电池工作时,中间室中的Cl-移向左室负极,故B错误;
C、硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+6H2O+10e-═N2↑+12OH-,故C正确;
D、因为有机物在厌氧菌作用下生成二氧化碳,所以每处理1molC6H12O6,转移6×(4-0)mol=24mol的电子,故D错误;
故选C.
点评 本题考查化学电源新型电池,题目难度中等,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

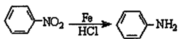 ,-NH2易被强氧化剂氧化
,-NH2易被强氧化剂氧化
 .
.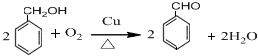 .
.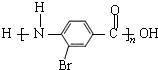 .
.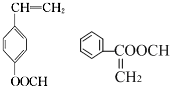 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:V2O4+xe-+xLi+=LixV2O4 | |
| B. | 该充电宝的凝胶介质也可用KOH溶液代替 | |
| C. | 充电时电池的正极得到电子后LixV2O4转化为V2O4 | |
| D. | 放电时每消耗7gLi,就会有1mol电子通过凝胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
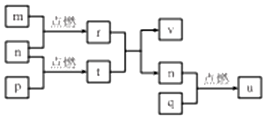 短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25℃,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示,下列说法不正确的是( )
短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25℃,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示,下列说法不正确的是( )| A. | 简单离子半径:W>Y>Z>X | |
| B. | W,Y分別与X元素形成的简单化合物的沸点:Y>W | |
| C. | Z2Y和ZX都只存在离子键 | |
| D. | v能抑制水的电离,u的水溶液能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m、n、q一定是非金属元素 | |
| B. | 氢化物的沸点:q>n>m | |
| C. | 离子半径的大小:q>n>p | |
| D. | m与q形成的二元化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
| A. | 达到平衡时,反应Ⅰ、Ⅱ对比,平衡常数:K(Ⅰ)>K(Ⅱ) | |
| B. | 对于反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 | |
| C. | 对于反应Ⅰ,若30min时只改变温度为T2℃,再次达到平衡时H2的物质的量为3.2mol,则T1>T2 | |
| D. | 对于反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
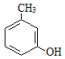 +CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$
+CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$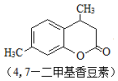 +C2H5OH+H2O
+C2H5OH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com