
| A. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 氢氧化钡与盐酸反应:OH-+H+=H2O |
分析 A.铁跟稀硫酸反应生成硫酸亚铁和氢气,不是生成三价铁;
B.铜和硝酸银溶液发生置换反应,该反应方程式左右电荷不守恒;
C.碳酸钙溶于盐酸生成氯化钙、水和二氧化碳,碳酸钙、水、二氧化碳应该写化学式;
D.氢氧化钡与盐酸反应的实质为氢离子与氢氧根离子反应生成水.
解答 解:A.铁跟稀硫酸反应反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.铜的金属活动性强于银,铜和硝酸银溶液发生置换反应,Cu+Ag+═Cu2++Ag该反应方程式左右电荷不守恒,正确的离子方程式为Cu+2Ag+═2Ag+Cu2+,故B错误;
C.碳酸钙溶于盐酸生成氯化钙、水和二氧化碳,碳酸钙、水、二氧化碳应该写化学式,正确的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D.氢氧化钡与盐酸反应生成氯化钡和水,反应的离子方程式为:OH-+H+=H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握判断离子方程式正误的常用方法,如:检查是否满足守恒关系(电荷守恒、质量守恒、电子守恒),反应物、生成物的拆分是否正确等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 将石蜡油加强热(裂解)所产生的气体通入酸性高锰酸钾溶液中 | 溶液褪色 | 产物不都是烷烃 |
| B | 向盛有3mL鸡蛋清溶液的试管里,滴入几滴浓硝酸 | 鸡蛋清变黄色 | 蛋白质可以发生颜色反应 |
| C | 将碘酒滴到新切开的土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHB的电离方程式为:NaHB?Na-+H-+B2- | |
| B. | NaHB溶液一定呈酸性 | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H20 | |
| D. | NaHB溶液中一定存在:c(Na+)+c(H+)═c(HB-)+2c(B2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,78g Na202中含有的阴离子数为2NA | |
| B. | 常温下,1L 0.1 mol/L NH4NO3溶液中含有的NH4 +数为0.1NA | |
| C. | 标准状况下,22.4 L己烷中含有的共价键的数目为19 NA | |
| D. | 30 g SiO2晶体中含有Si-O键的数目为2 Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
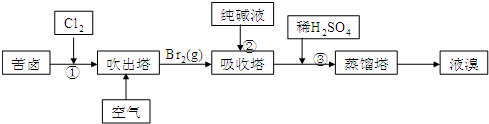
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 两极材料 | 石墨、石墨 | Zn片、Cu片 | Zn片、Cu片 | 石墨、Cu片 |
| 插入溶液 | H2SO4溶液 | 乙醇溶液 | 稀盐酸 | H2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2CH3)CH2CH3 2-乙基丁烷 | B. | CH2CHBr2 二氯乙烷 | ||
| C. | CH3CH(CH3)CH=CH2 2-甲基丁烯 | D. | 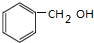 苯甲醇 苯甲醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com